背景:
具有单分散和均匀尺寸的水凝胶微球由于能够提供类似的体内微环境,在三维(3D)细胞培养领域具有广泛的潜在应用。目前,海藻酸盐水凝胶微球(AHMs)因其良好的生物相容性、低沉本、无毒性和生物降解性而备受关注。AHMs的制备方法主要包括挤出、静电滴注和微流控芯片技术,但这些方法往往需要在操作复杂性、制造成本和实际应用之间进行权衡。

导读:
近期,山东大学程永强团队提出了一种基于多孔板的新型多功能平台,通过重力驱动和弯曲毛细管离心驱动系统在线制备AHMs,并实现了原位3D细胞培养和快速药物敏感性测试。相关研究以“Multi-well plate-based versatile platform for online fabricating alginate hydrogel microspheres and in-situ 3D cell culture”为题目,发表在期刊《Analytica Chimica Acta》上。
本文要点:
1、本研究提出了一种基于多孔板的新型多功能平台,用于在线制备AHMs和原位3D细胞培养。
2、结合重力驱动凝胶化和弯曲毛细管离心驱动(BCCD)系统,开发了一种简单的AHMs制备方法。
3、Ca-EDTA复合物用作藻酸盐链交联反应的Ca2+来源,AHMs的整个制备过程包括乳化、预凝胶化、自发破乳和进一步固化四个步骤,能够生成良好球形度和单分散性的微球。
4、这项研究还展示了AHMs在快速药物敏感性测试和单细胞包封中的应用,细胞存活率超过85%。
5、该平台避免了复杂而费力的微加工过程,细胞包封AHMs可以直接在多孔板中产生,以便后续的培养和观察,其有望成为生物医学和组织工程领域的多功能原位3D细胞培养工具。
AHMs(海藻酸盐水凝胶微球)的制备过程包括以下四个关键步骤:
1、乳化(Emulsification):在BCCD系统的帮助下,将海藻酸盐溶液乳化成均匀的滴液。
2、预凝胶化(Pre-gelation):在油相中进行外部交联,使海藻酸盐滴液形成球形的外壳。此过程使用了Ca-EDTA复合物作为Ca2+源。
3、自发破乳(Spontaneous demulsification):在重力作用下,形成的滴液突破油水界面,进入CaCl2浴中,油膜自发去除。
4、固化(Solidification):Ca2+从固化剂层渗透到海藻酸盐滴液的内部,进行内部交联,进一步固化形成AHMs。
该制备过程结合了重力驱动的凝胶化和BCCD系统的优势,能够高效、可控地制备出均匀的AHMs。
使用海藻酸盐水凝胶微球(AHMs)在3D细胞培养中的优势包括:
1、生物相容性:海藻酸盐具有良好的生物相容性,能够支持细胞的生长和存活。
2、可调节的微环境:AHMs能够提供类似于体内的微环境,促进细胞间的相互作用和生物功能。
3、单分散性和均匀性:通过新开发的多孔板平台,AHMs可以实现良好的球形度和单分散性,这对于细胞培养的均匀性至关重要。
4、简化的制备过程:AHMs的制备过程相对简单,结合重力驱动的凝胶化和弯曲毛细管离心驱动系统,避免了复杂的微加工步骤。
5、便于细胞包埋和培养:AHMs可以直接在多孔板中产生,便于细胞的包埋、培养和观察,减少了转移过程中的损失和污染风险。
6、营养物质交换:AHMs的结构支持营养物质和代谢物的有效交换,有利于维持细胞的活性和功能。
7、快速药物敏感性测试:AHMs能够在培养过程中进行快速的药物敏感性测试,提高了实验的效率和准确性。
8、适用于大规模培养:该平台支持在多孔板中进行大规模的细胞培养,适合于生物医学和组织工程的研究与应用。
综上所述,AHMs在3D细胞培养中提供了一个多功能、可扩展且经济高效的解决方案,具有广泛的应用前景。
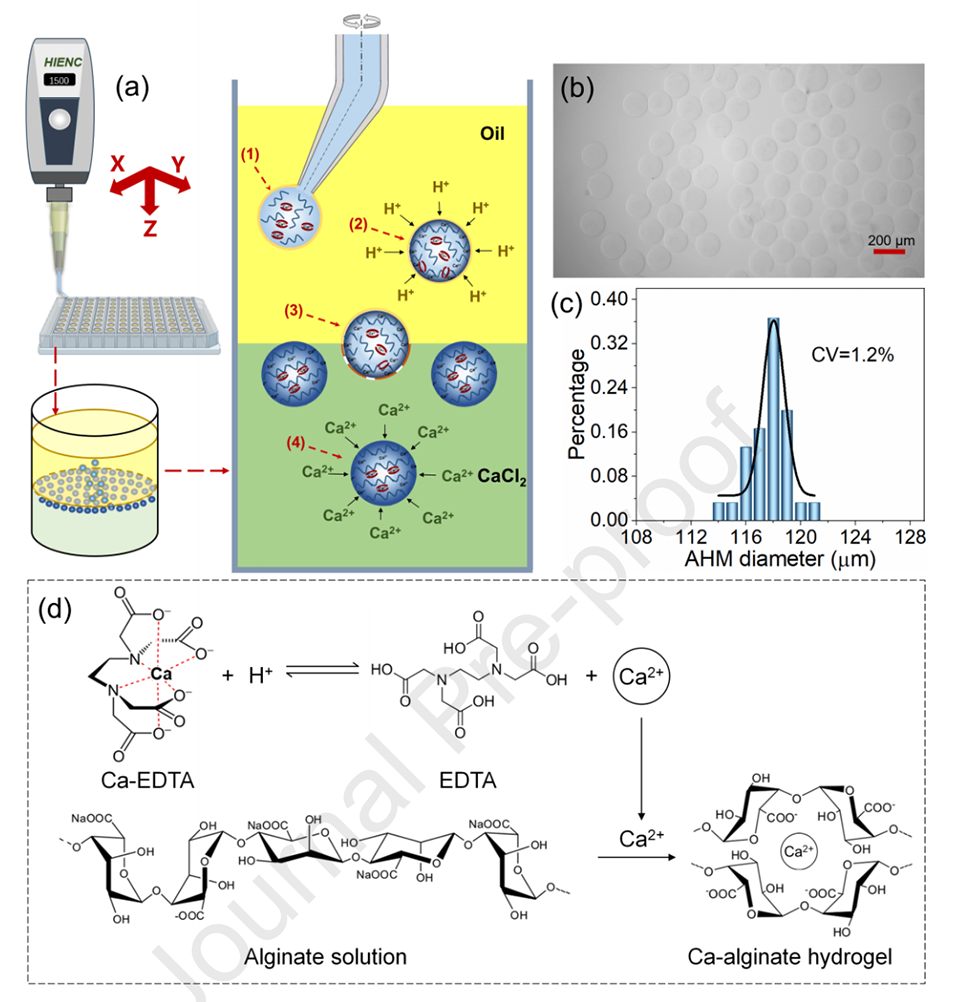
图1.(a)AHMs制备过程示意图,(1)乳化,(2)预凝胶化,(3)自发破乳,(4)固化。(b)单分散AHMs的典型照片(比例尺,200μm)。(c)图(b)中AHMs的尺寸分布分析。(d)Ca-EDTA复合物解离和海藻酸钙水凝胶交联的反应方案。在酸性条件下,Ca2+从液滴外层的Ca-EDTA复合物中释放出来,与藻酸盐链形成离子网络。在CaCl2浴中,Ca2+与藻酸盐链交联形成离子网络。
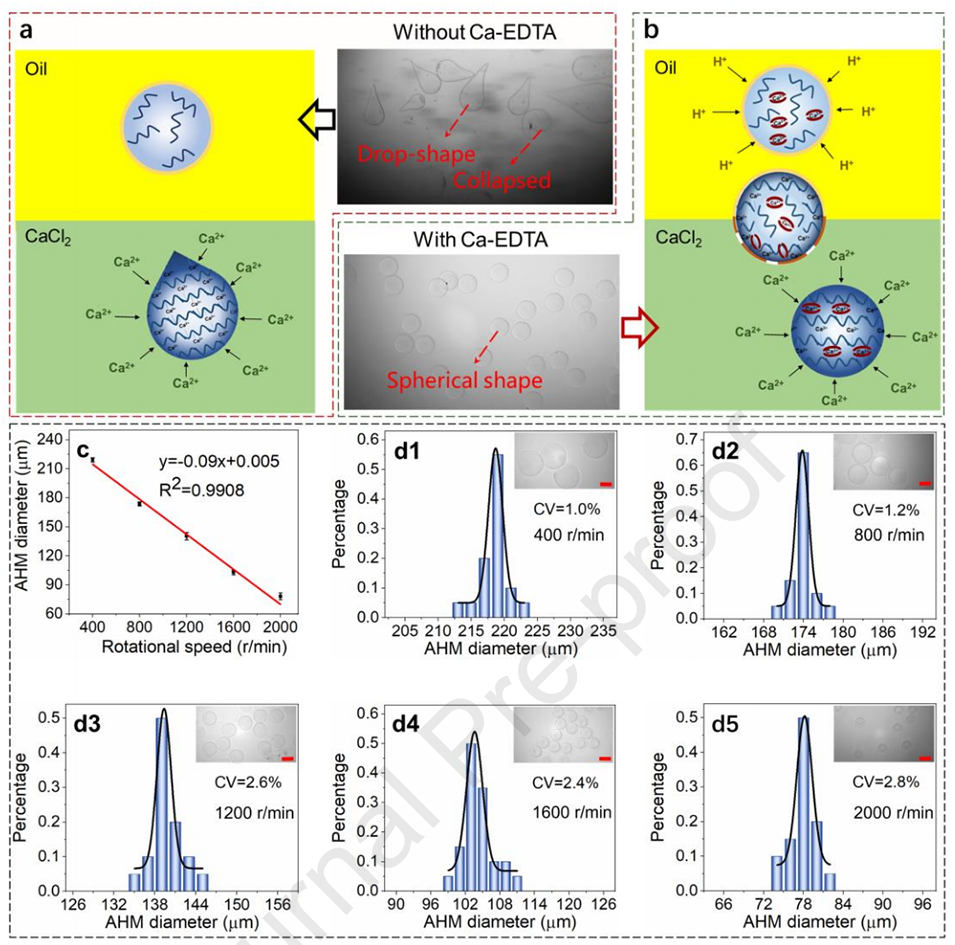
图2.(a)不含Ca-EDTA的藻酸盐液滴产生了滴状塌陷的AHMs。(b)含Ca-EDTA的藻酸盐液滴产生了球形AHMs。(c)AHMs的直径与转速呈线性关系。(d)(d1)400r/min、(d2)800r/min、(d3)1000r/min、(d4)1200r/min、(d5)1600r/min不同转速下生成的AHMs的尺寸分布分析(比例尺,100μm)。实验重复了三次。
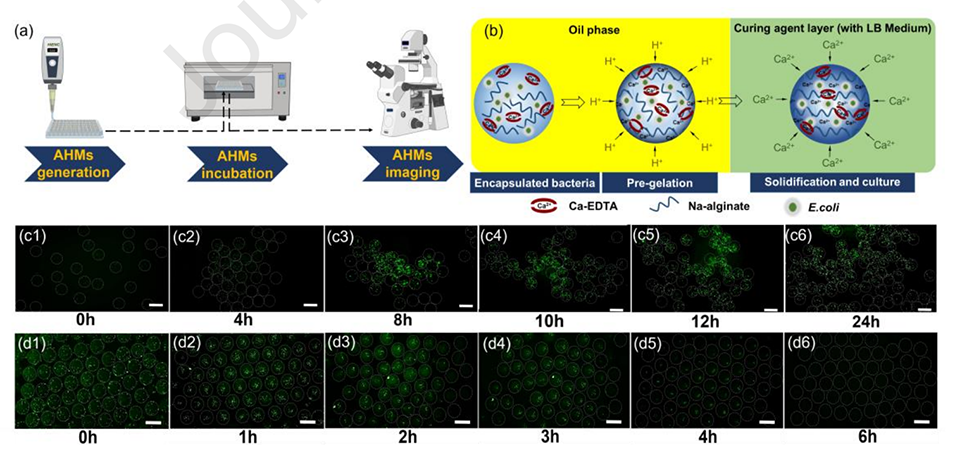
图3.(a)大肠杆菌MG1655包封AHMs的生成、培养和观察示意图。(b)大肠杆菌MG1655包封AHMs的生成原理示意图。(c1-c6)大肠杆菌MG1655在AHMs中生长的荧光照片。(d1-d6)大肠杆菌MG1655在液滴中生长的荧光照片。比例尺为200μm。
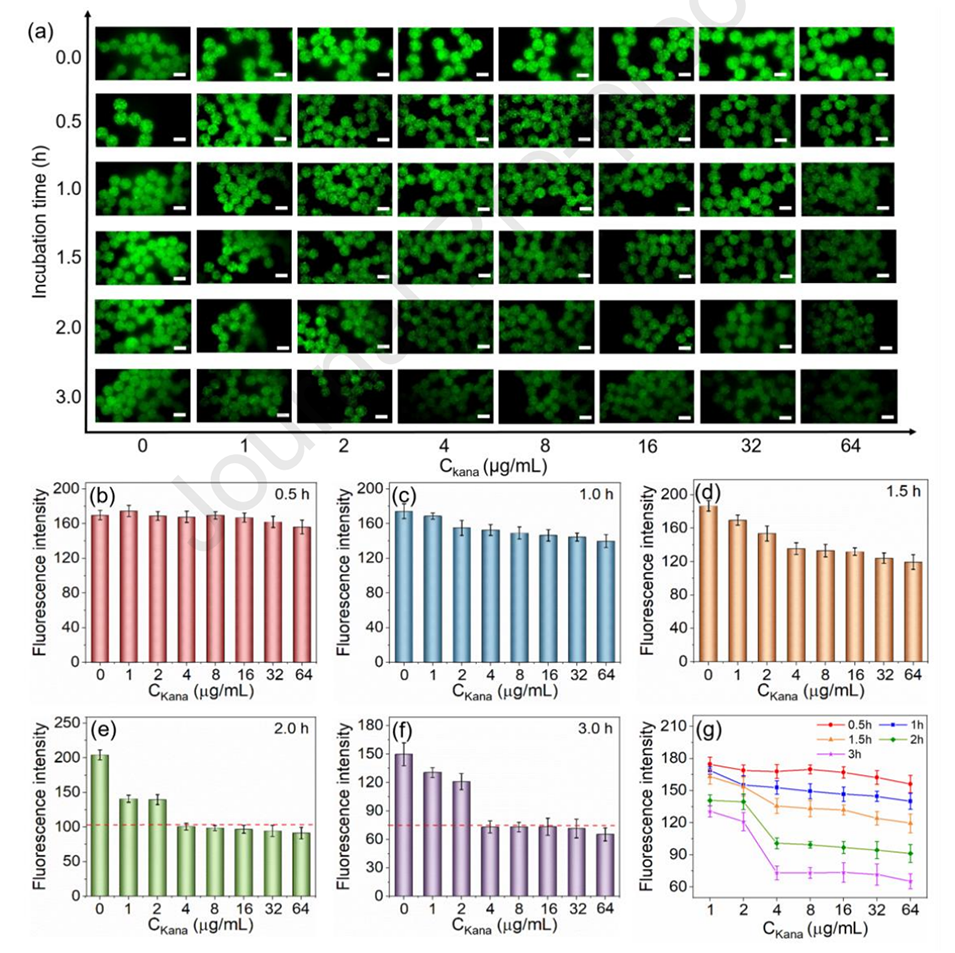
图4.基于AHMs的药物敏感性测试。(a)药物敏感性测试的典型荧光图像。(比例尺,100μm)。(b-f)(b)0.5h、(c)1h、(d)1.5h、(e)2h和(f)3h孵育后,不同卡那霉素浓度下AHMs的荧光强度。(g)3h孵育期间不同卡那霉素浓度下的药物敏感性测试曲线。
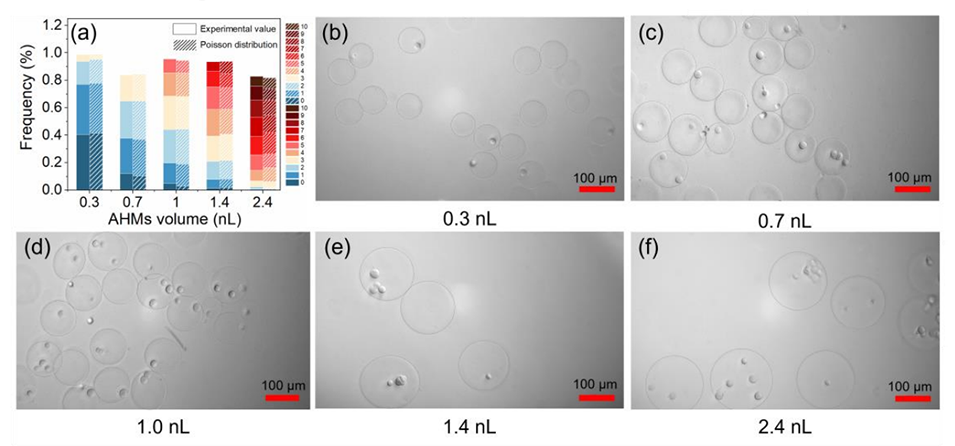
图5.(a)不同体积AHMs中细胞的包封率。(b-f)体积为(b)0.3nL、(c)0.7nL、(d)1.0nL、(e)1.4nL和(f)2.4nL的细胞包封AHMs的典型照片。(比例尺,100μm)
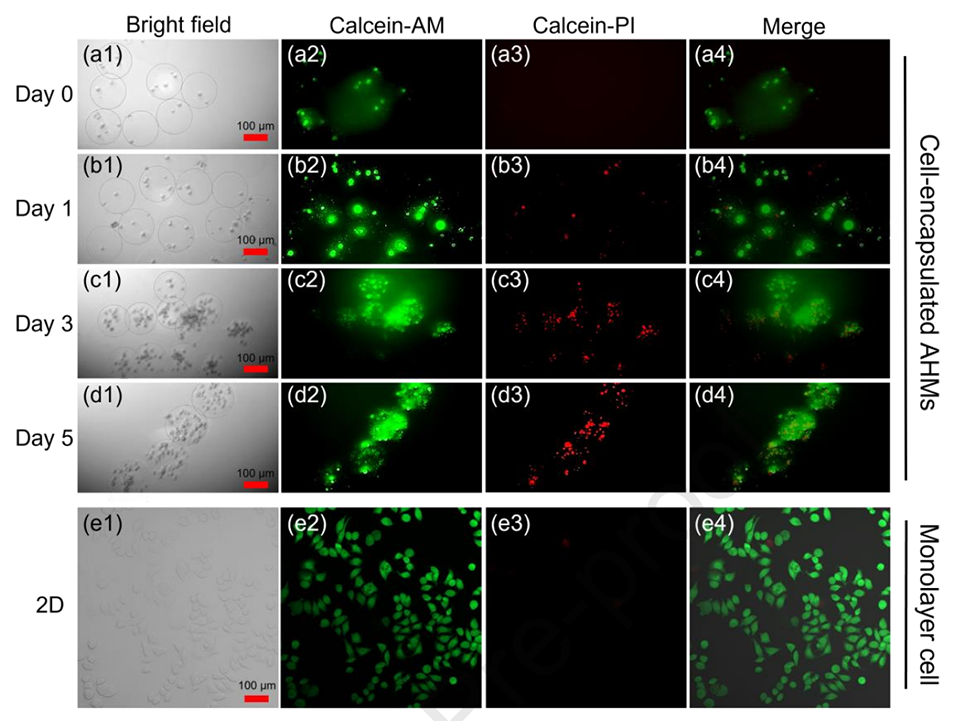
图6.(a-d)HeLa细胞包封AHMs在5天培养期间的典型亮场和荧光图像。(比例尺,100μm)(e)2D培养中HeLa细胞的典型亮场和荧光图像。(比例尺,100μm)。绿色荧光表示活细胞,红色荧光表示死细胞。
论文链接:https://doi.org/10.1016/j.aca.2024.343427














