体外人类肝脏模型对于化合物代谢/毒性筛选、疾病建模和再生医学是不可或缺的。诱导多能干细胞衍生人肝细胞样细胞(iHeps)虽解决了原代人肝细胞(PHHs)的来源限制,但其功能成熟度仍是应用瓶颈。在发育过程中,未成熟的肝母细胞通过与间充质、内皮等非实质细胞(NPCs)的时空相互作用实现功能成熟,体外模拟该过程对于阐明iHep成熟的关键调节因子至关重要。

近期,美国伊利诺伊大学芝加哥分校研究团队采用高通量液滴微流控技术,将诱导多能干细胞衍生肝细胞样细胞(iHeps)包裹于直径约250μm的单分散I型胶原微凝胶中构建微组织,再用不同非实质细胞(NPCs)包覆微组织,置于微孔板培养。结合Transwell插入物实现动态异源信号模拟,同时通过细胞因子阵列、基因表达分析、免疫染色等评估iHeps成熟度。相关研究以“Engineered microtissues to model the effects of dynamic heterotypic cell signaling on iPSC-derived human hepatocyte maturation”为题目,发表在期刊《Acta Biomaterialia》上。
本文要点:
1、本研究利用高通量液滴微流控技术,将诱导多能干细胞衍生的人肝细胞样细胞(iHeps)封装于单分散I型胶原微凝胶中构建微组织,并包覆不同非实质细胞(NPCs),以研究动态异型细胞信号对iHep成熟的影响。
2、研究发现,与成体肝星状细胞、门静脉成纤维细胞、真皮成纤维细胞和人脐静脉内皮细胞相比,胚胎成纤维细胞和肝窦内皮细胞(LSEC)在长达4周以上的培养中能最有效地促进iHep成熟。
3、通过Transwell共培养模拟动态信号交互,发现先引入胚胎成纤维细胞信号、后引入LSEC信号的顺序可诱导最高水平的iHep成熟。
4、细胞因子谱分析揭示了不同共培养模式下独特的分泌特征,并验证了基质细胞衍生因子-1α对iHep成熟的促进作用。基因表达分析表明,LSEC/iHep微组织表现出与成人原代肝细胞相似的成熟特征。
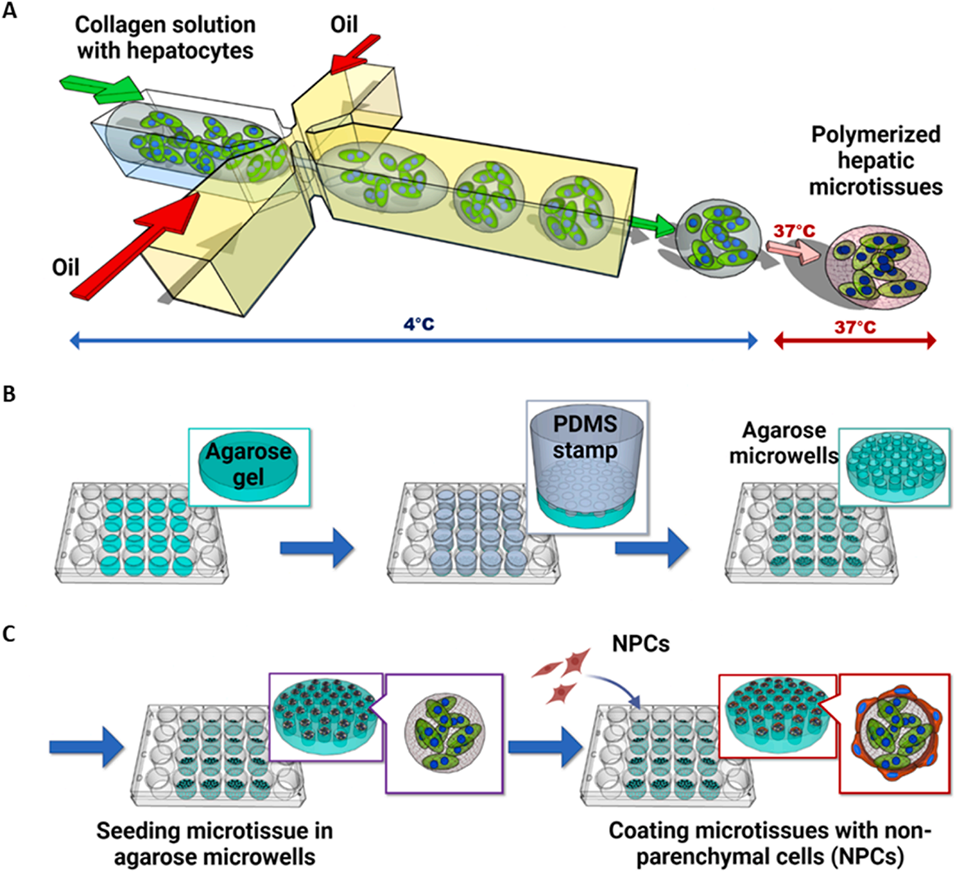
图1:微组织的制备与培养
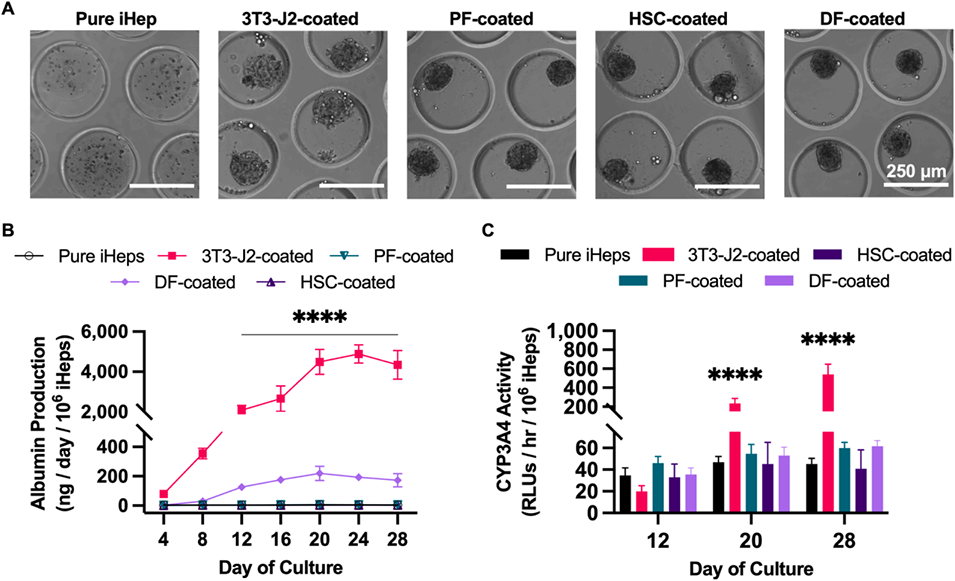
图2:间充质细胞对微组织中iHep成熟的影响
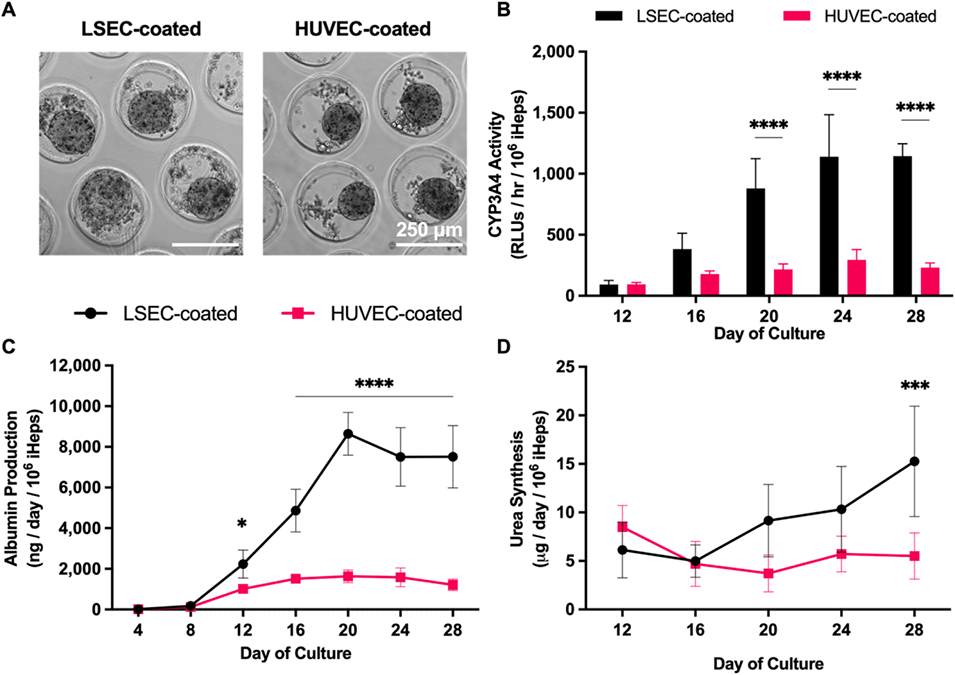
图3:内皮细胞对微组织中iHep成熟的影响
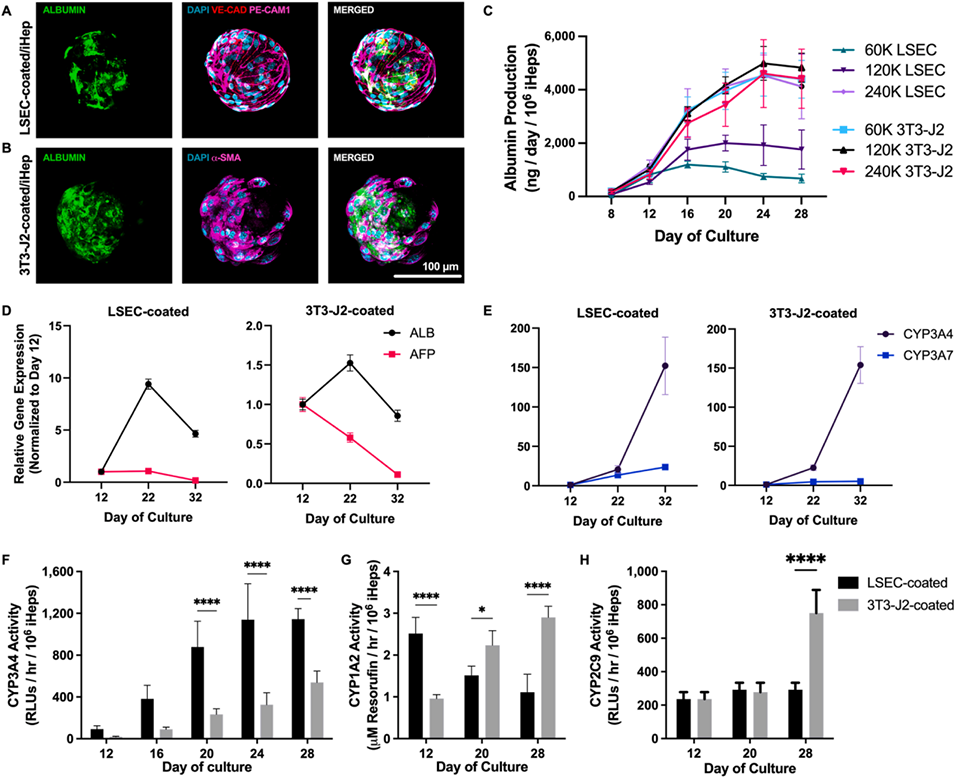
图4:间充质细胞与内皮细胞刺激对iHep成熟影响的比较
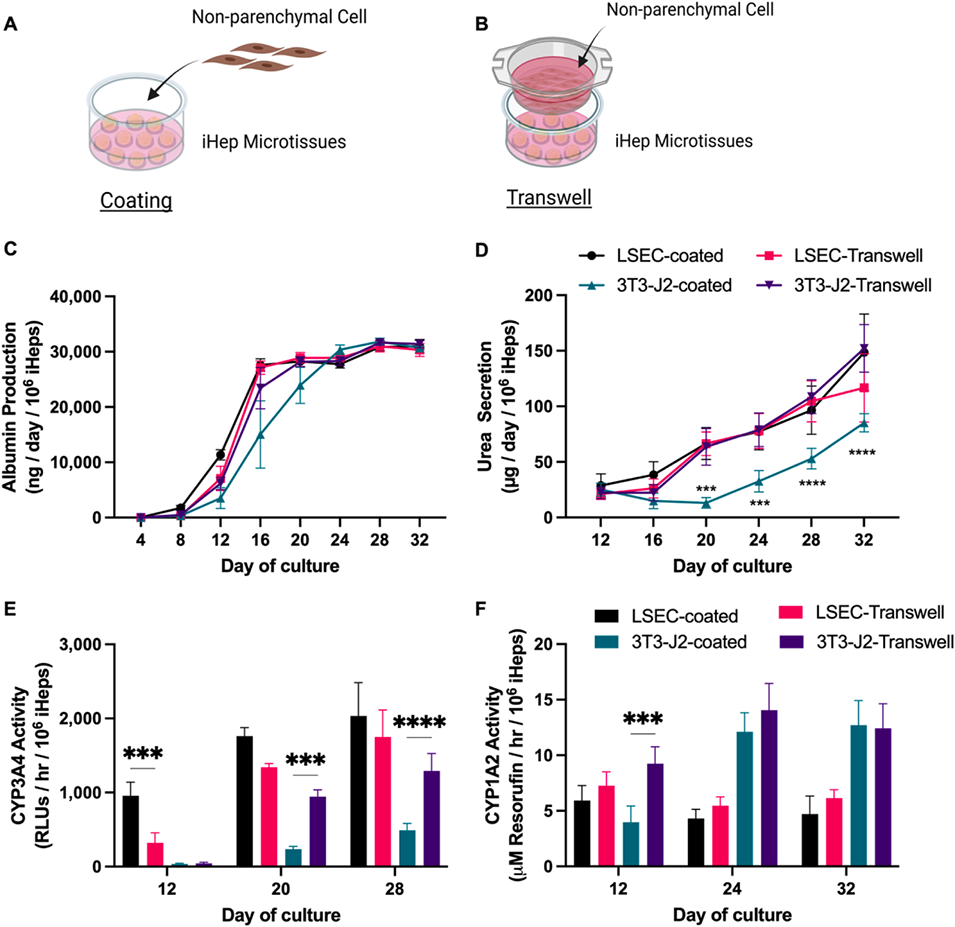
图5:NPC与iHep的距离(直接接触vs.间接旁分泌)对iHep成熟的作用
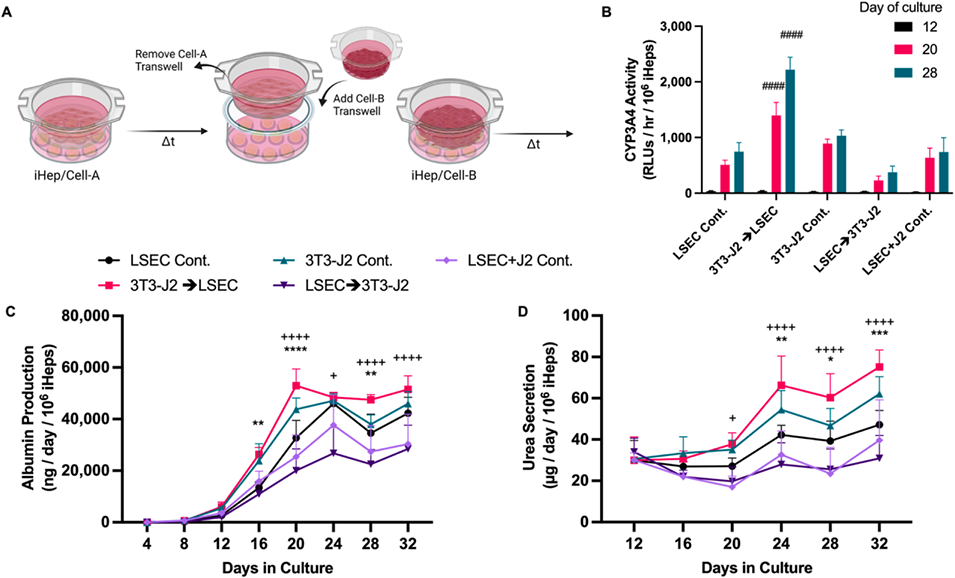
图6:NPC动态旁分泌信号对iHep成熟的影响
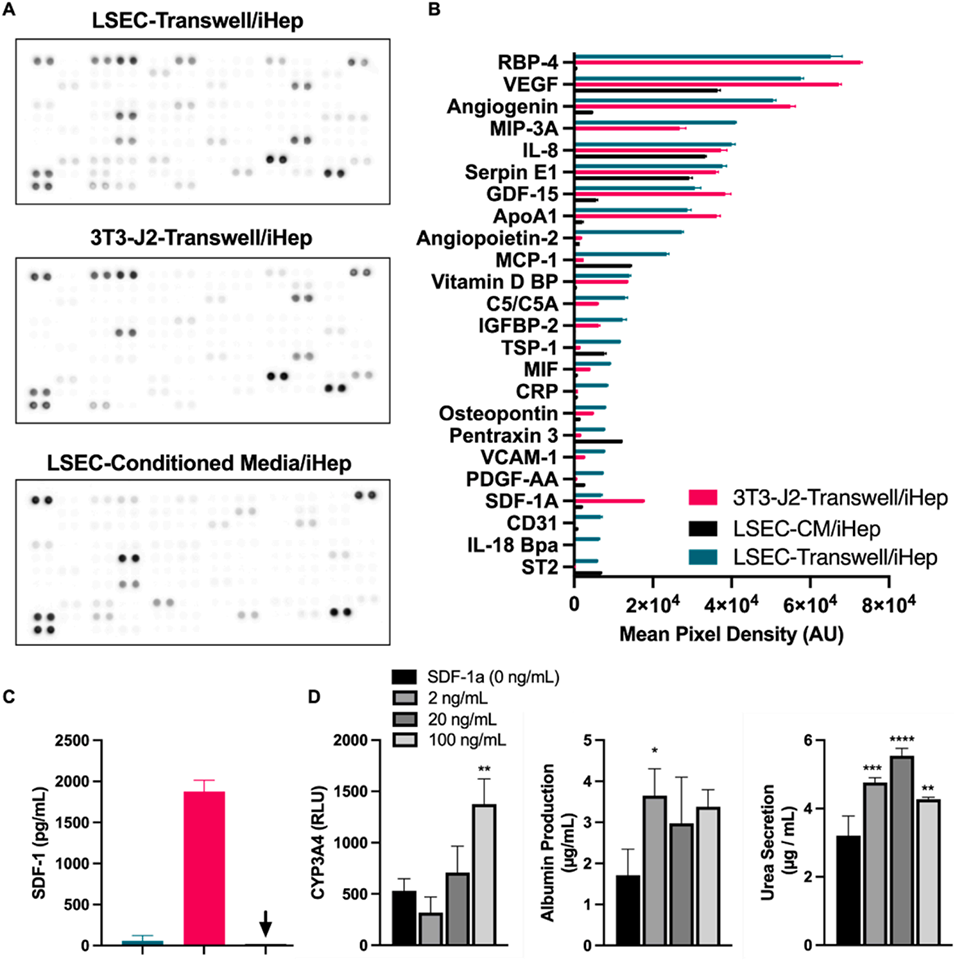
图7:NPC/iHep微组织的细胞因子分泌谱
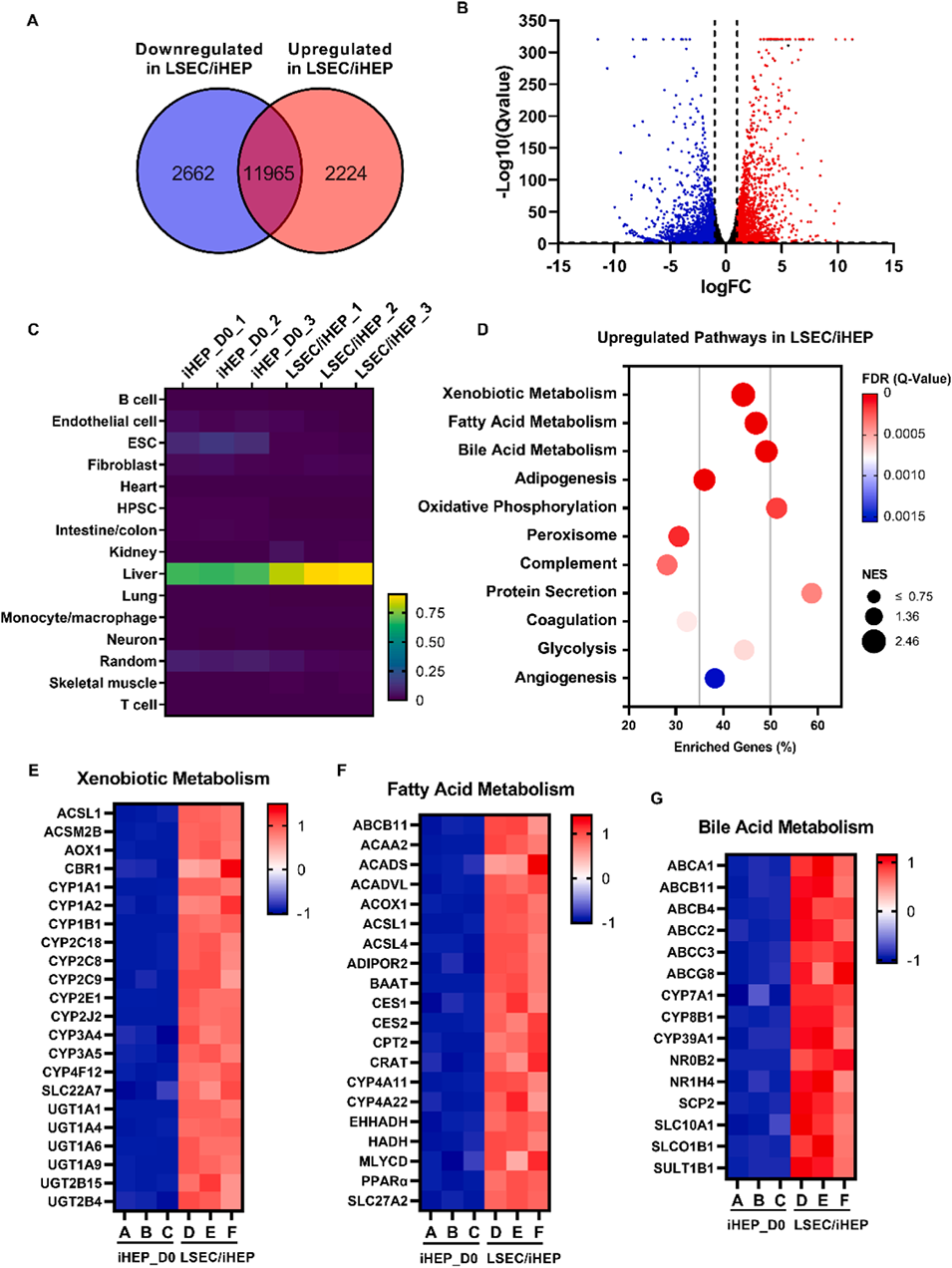
图8:LSEC/iHep微组织的RNA测序分析
论文链接:https://doi.org/10.1016/j.actbio.2025.03.020
(本文仅供参考学习及传递微流控研究成果,版权归原作者所有,如侵犯权益,请联系删除)














