
导读:
近期,有研究人员通过结合自由基开环聚合(rROP)和聚合诱导自组装(PISA)技术,成功实现了可降解聚合物前药纳米粒子的原位合成。该方法不仅解决了传统预合成聚合物纳米粒子浓度低、药物负载量低以及药物突释等问题,还通过在纳米粒子核心中引入可降解的酯键,实现了纳米粒子的水解降解,显著提高了其生物相容性和细胞摄取效率。相关研究以“In situ synthesis of degradable polymer prodrug nanoparticles”为题目发表于期刊《Chemical Science》。
本文要点:
1、本研究通过结合自由基开环聚合(rROP)与聚合诱导自组装(PISA)技术,开发了一种原位合成可降解聚合物前药纳米颗粒的新方法。
2、该技术以聚乙二醇为亲水性嵌段,通过可逆加成一断裂链转移(RAFT)聚合将甲基丙烯酸月桂酯(LMA)、环烯酮缩醛(CKA)及抗癌药物(紫杉醇或吉西他滨)的甲基丙烯酸酯衍生物共聚,形成核-壳结构纳米颗粒。
3、实验表明,该方法可制备高固含量(20 wt%)、粒径56-225 nm的稳定水分散体系,药物负载量最高达33 wt%。
4、纳米颗粒核心中引入的酯键赋予其水解降解性,加速降解实验证实了聚合物链的断裂。
5、细胞实验显示,载药纳米颗粒对A549肺癌细胞具有显著毒性(IC50为1.4-14.9 μM),且通过荧光标记证实其高效细胞摄取。
6、该策略可适配不同CKA单体和药物分子,结合荧光成像功能,为可降解药物递送系统的开发提供了通用平台。
rROP和PISA技术的简要介绍
rROP(自由基开环聚合):
定义:自由基开环聚合是一种结合自由基聚合与开环反应的技术,通过环状单体(如环烯酮缩醛CKA)的开环形成含可降解键(如酯键)的聚合物链。
特点:
可降解性:开环反应引入酯键等可水解基团,赋予材料生物降解性。
单体多样性:适用于多种环状单体和乙烯基单体,灵活调控聚合物性能。
可控性:通过RAFT(可逆加成-断裂链转移)实现分子量可控及窄分布。
应用:
生物医学领域(如可降解药物载体、手术缝合线)。
环保材料(如短寿命包装材料)。
PISA(聚合诱导自组装):
定义:在聚合过程中,随着疏水链段的增长,原位诱导嵌段共聚物自组装形成纳米结构(如球形、囊泡)。
特点:
一步合成:聚合与自组装同步完成,简化流程。
高固含量(如20 wt%),适合大规模生产。
形态可控:通过单体比例、溶剂等调控纳米颗粒尺寸与形貌。
应用:
药物递送系统(如高载药量纳米颗粒)。
功能纳米材料(如纳米反应器、催化载体)。
结合rROP与PISA(如rROPISA)制备的可降解纳米载药颗粒兼具高药物负载(如紫杉醇达33 wt%)、稳定分散(水相粒径56-225 nm)及可控释放(水解降解)等特性,为癌症治疗提供了高效平台。
这种通过rROP和PISA技术制备的可降解聚合物前药纳米粒子在药物递送方面具有以下优势:
1、高药物负载量:通过原位合成,药物与聚合物骨架共价连接,避免了传统物理包载方法的局限性,实现了高达33 wt%的药物负载量,显著提高了药物递送效率。
2、可降解性:纳米粒子核心的酯键设计使其在生理条件下可水解降解,减少了长期积累的毒性,提高了临床转化潜力。
3、稳定性:纳米粒子在水溶液中表现出良好的稳定性,能够在较长时间内保持其结构和药物负载能力,减少了药物的突释现象。
4、细胞摄取效率:纳米粒子能够被癌细胞有效摄取,通过荧光标记可以实时监测其在细胞内的分布,为药物递送提供了可视化手段。
5、多功能性:该技术不仅可用于药物递送,还可通过荧光标记实现成像功能,具有潜在的诊疗一体化(theranostic)应用前景。
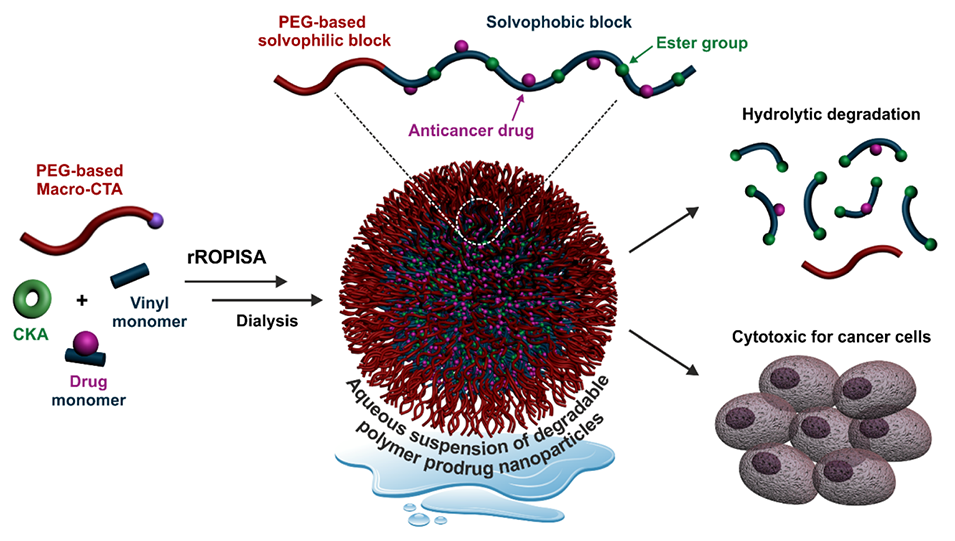
图1:通过自由基开环聚合诱导自组装(rROPISA)由环烯酮缩醛(CKAs)和药物单体合成可降解的嵌段共聚物前药纳米粒子的示意图。展示了以聚(乙二醇)为基础的亲水性嵌段通过可逆加成断裂链转移(RAFT)共聚反应进行链延伸,形成包含药物单体和CKAs的疏水性嵌段,最终形成纳米粒子的过程。
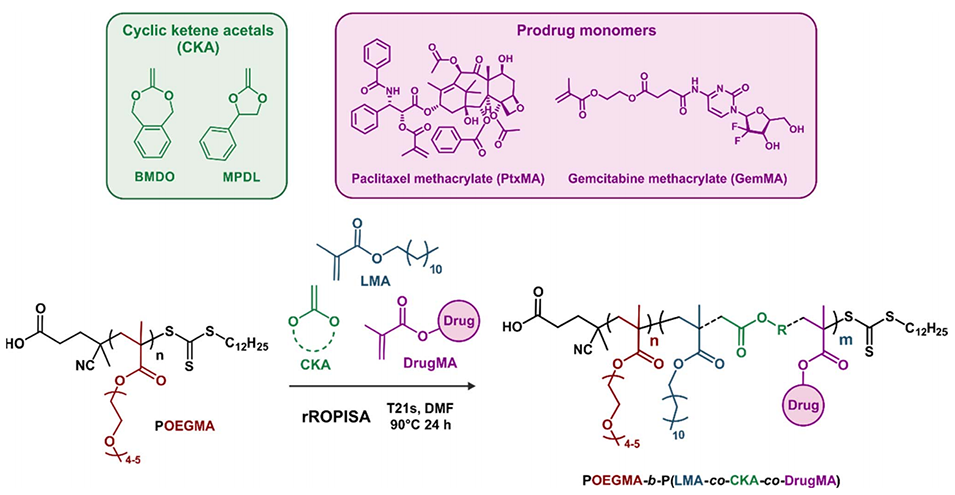
图2:RAFT介导的聚[寡(乙二醇)甲基丙烯酸酯](POEGMA)大分子链转移剂在DMF中与甲基丙烯酸月桂酯(LMA)、环烯酮缩醛(CKAs)和载药甲基丙烯酸酯(DrugMA)进行rROPISA的过程示意图,随后将得到的纳米粒子转移到水中,产生POEGMA-b-P(LMA-co-CKA-co-DrugMA)嵌段共聚物前药纳米粒子的水悬浮液。展示了纳米粒子的合成过程和结构组成。
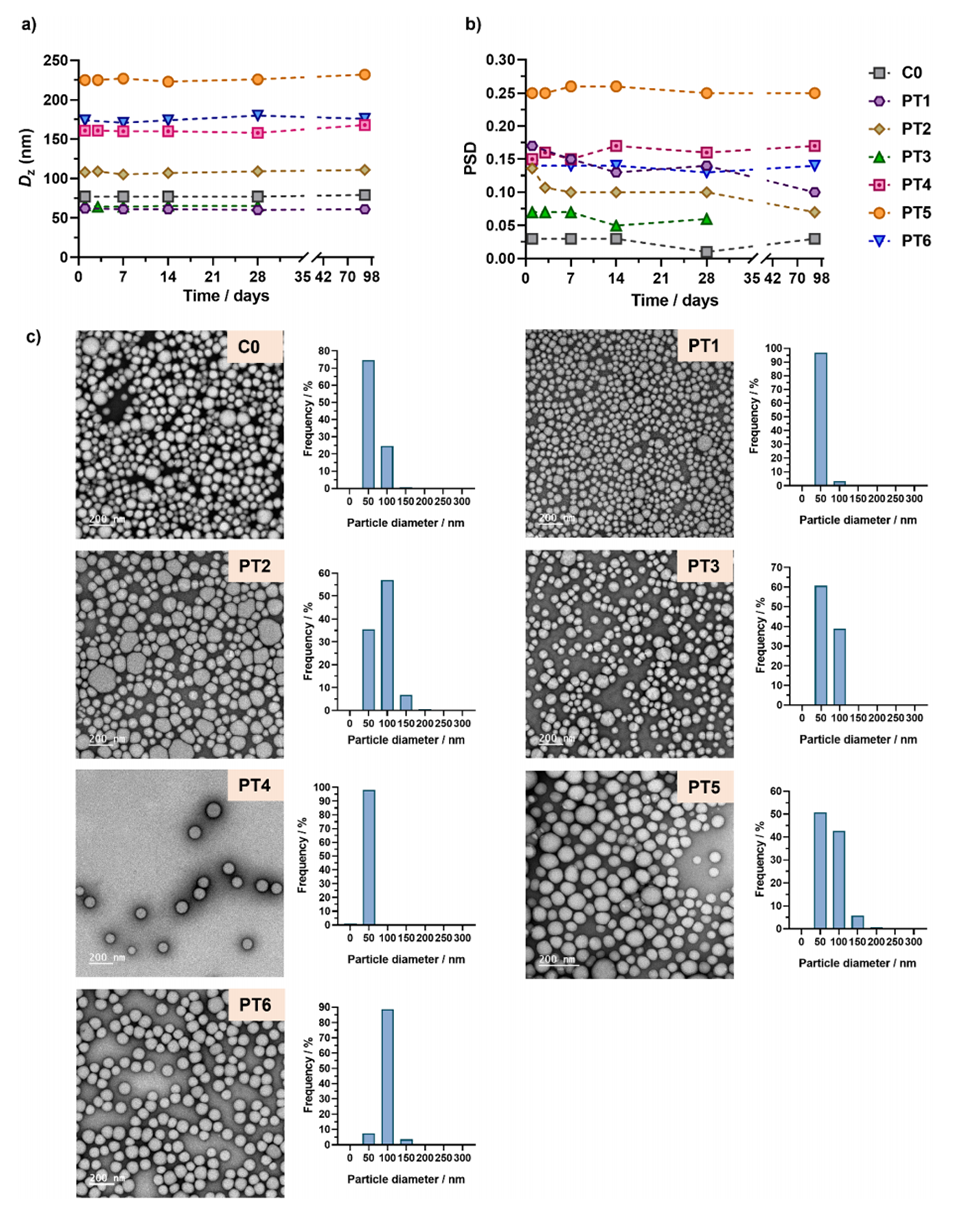
图3:(a)和(b)POEGMA28-b-P(LMA-co-CKA-co-PtxMA)纳米粒子C0和PT1–PT6在水中分散后的尺寸变化情况,通过动态光散射(DLS)测量得到的强度加权平均直径(Dz)和粒径分布(PSD)随时间的变化图;(c)这些纳米粒子的代表性透射电子显微镜(TEM)图像;(d)通过TEM测量的纳米粒子的粒径分布图,给出了数量平均直径(dn)、重量平均直径(dw)、Z平均直径(dz)和多分散指数(PDI)的数值。这些图展示了纳米粒子的尺寸稳定性、形态和粒径分布情况。
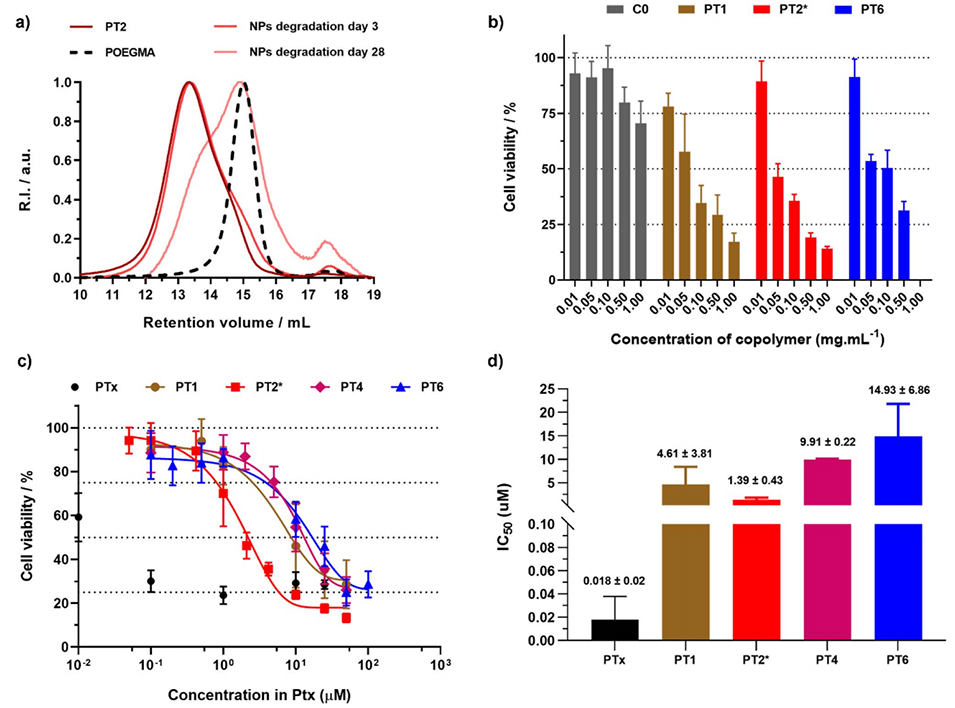
图4:(a)在加速条件下,共聚物和纳米粒子PT2降解后的SEC色谱图,虚线表示对应的POEGMA28大分子链转移剂的SEC曲线;(b)A549细胞与不同浓度的纳米粒子C0、PT1、PT2和PT6共孵育72小时后的细胞活性(MTT实验)结果,以共聚物质量浓度表示;(c)A549细胞与游离紫杉醇和纳米粒子PT1、PT2、PT4和PT6共孵育72小时后的细胞活性(MTT实验)结果,以紫杉醇摩尔浓度表示;(d)对应的IC50值。这些图展示了纳米粒子的降解情况和对癌细胞的毒性效果。
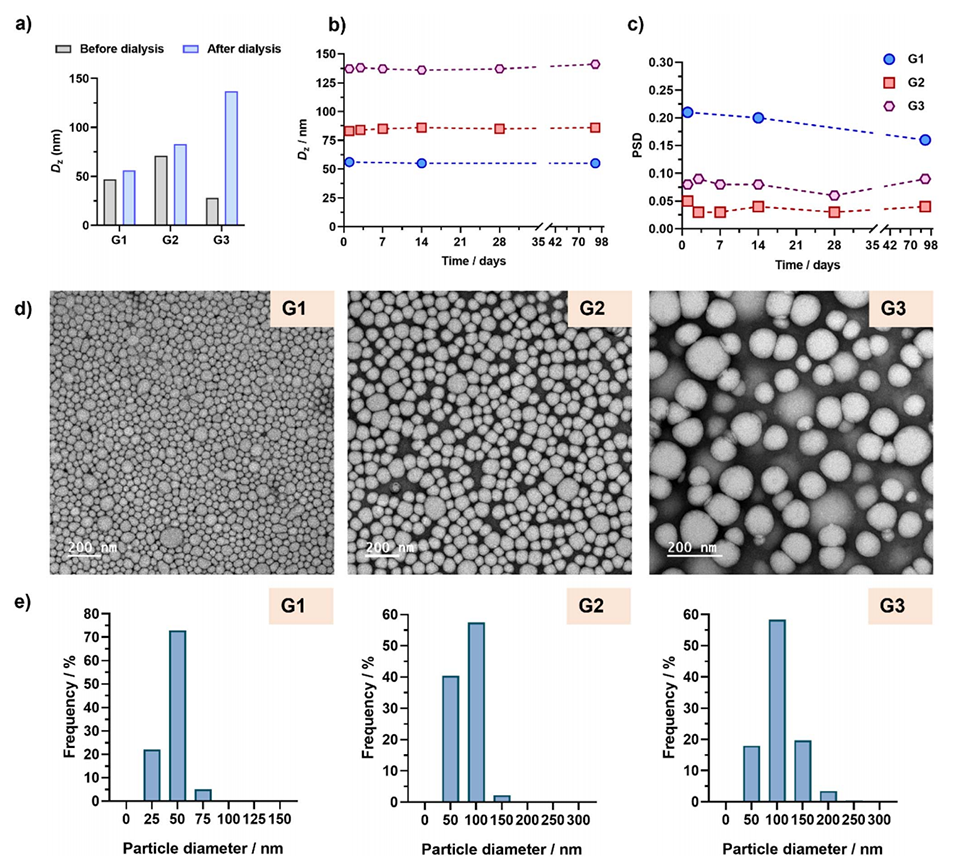
图5:(a)POEGMA28-b-P(LMA-co-CKA-co-GemMA)共聚物纳米粒子G1–G3在DMF中和经过水透析后的强度加权平均直径(Dz)的柱状图;(b)和(c)纳米粒子G1–G3在水中分散后,随时间变化的Dz和粒径分布(PSD)图;(d)这些纳米粒子的代表性TEM图像;(e)通过TEM测量的纳米粒子的粒径分布图。这些图展示了纳米粒子在不同溶剂中的尺寸变化、稳定性以及形态和粒径分布情况。
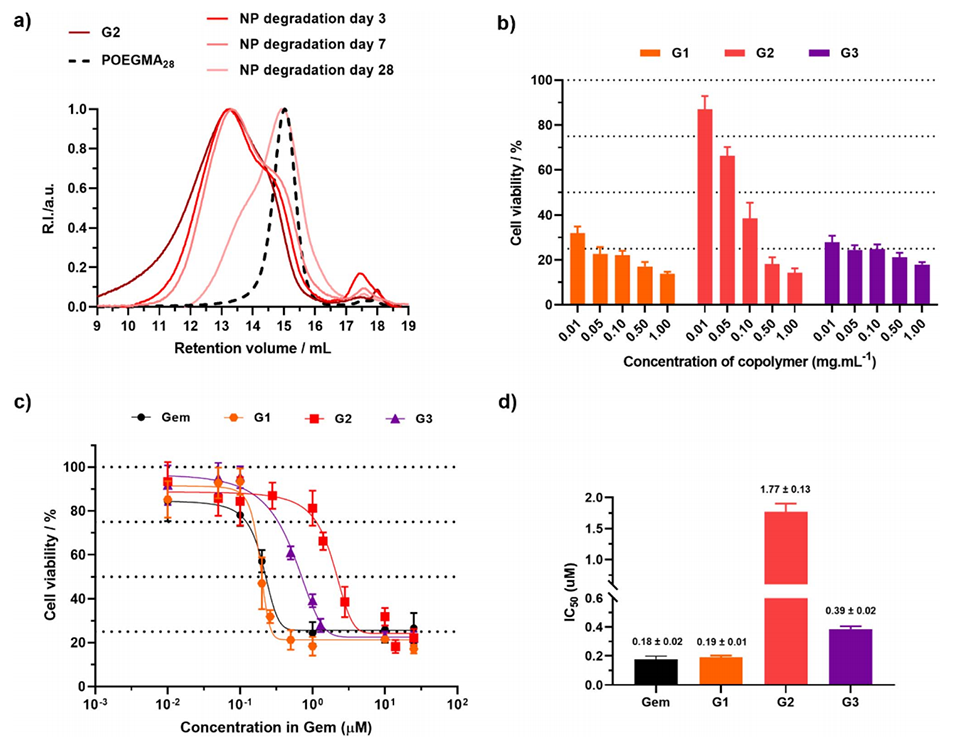
图6:(a)在加速条件下,共聚物和纳米粒子G2降解后的SEC色谱图;(b)A549细胞与不同浓度的纳米粒子G1–G3共孵育72小时后的细胞活性(MTT实验)结果,以共聚物质量浓度表示;(c)A549细胞与纳米粒子G1–G3共孵育72小时后的细胞活性(MTT实验)结果,以吉西他滨摩尔浓度表示;(d)对应的IC50值。这些图展示了纳米粒子的降解情况和对癌细胞的毒性效果。
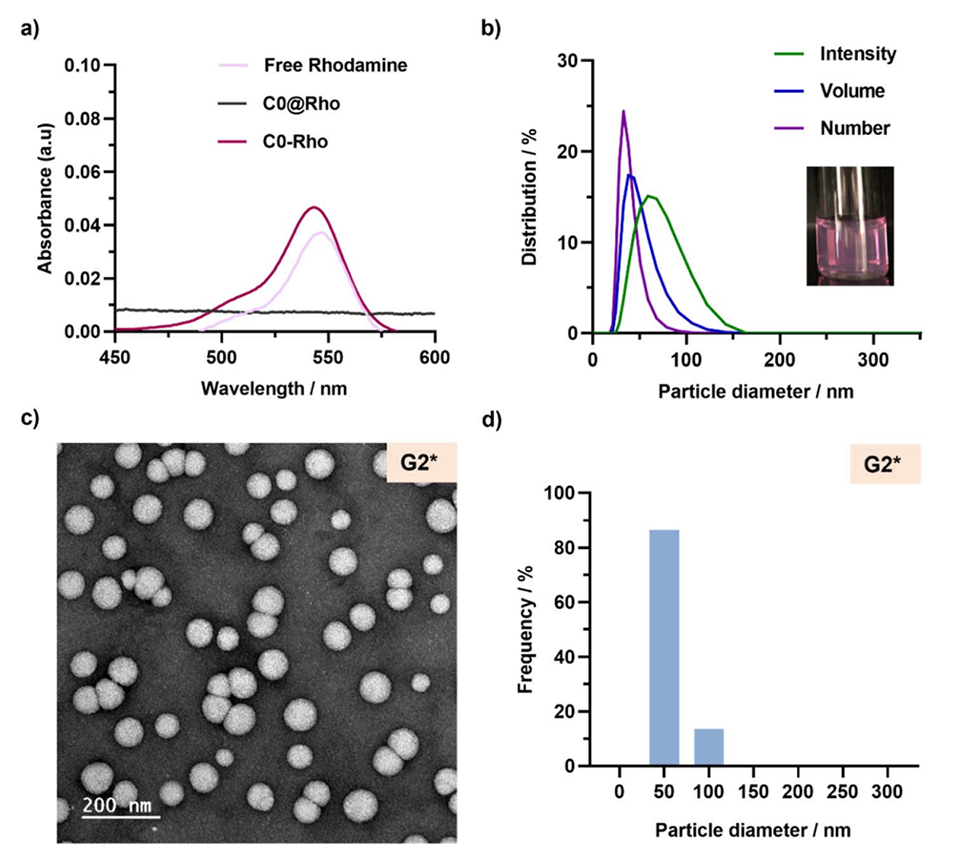
图7:(a)游离罗丹明B(Rho)、P(OEGMA24-co-RhoMA)-b-P(LMA-co-BMDO)共聚物(C0-Rho)和POEGMA28-b-P(LMA-co-BMDO)共聚物(C0@Rho)的吸收光谱图;(b)纳米粒子G2的DLS测量结果,给出了平均直径在强度、体积和数量上的表达,插图是纳米粒子G2的水悬浮液照片;(c)纳米粒子G2的代表性TEM图像;(d)通过TEM测量的纳米粒子G2的粒径分布图。这些图展示了荧光标记的纳米粒子的光谱特性、尺寸和形态。
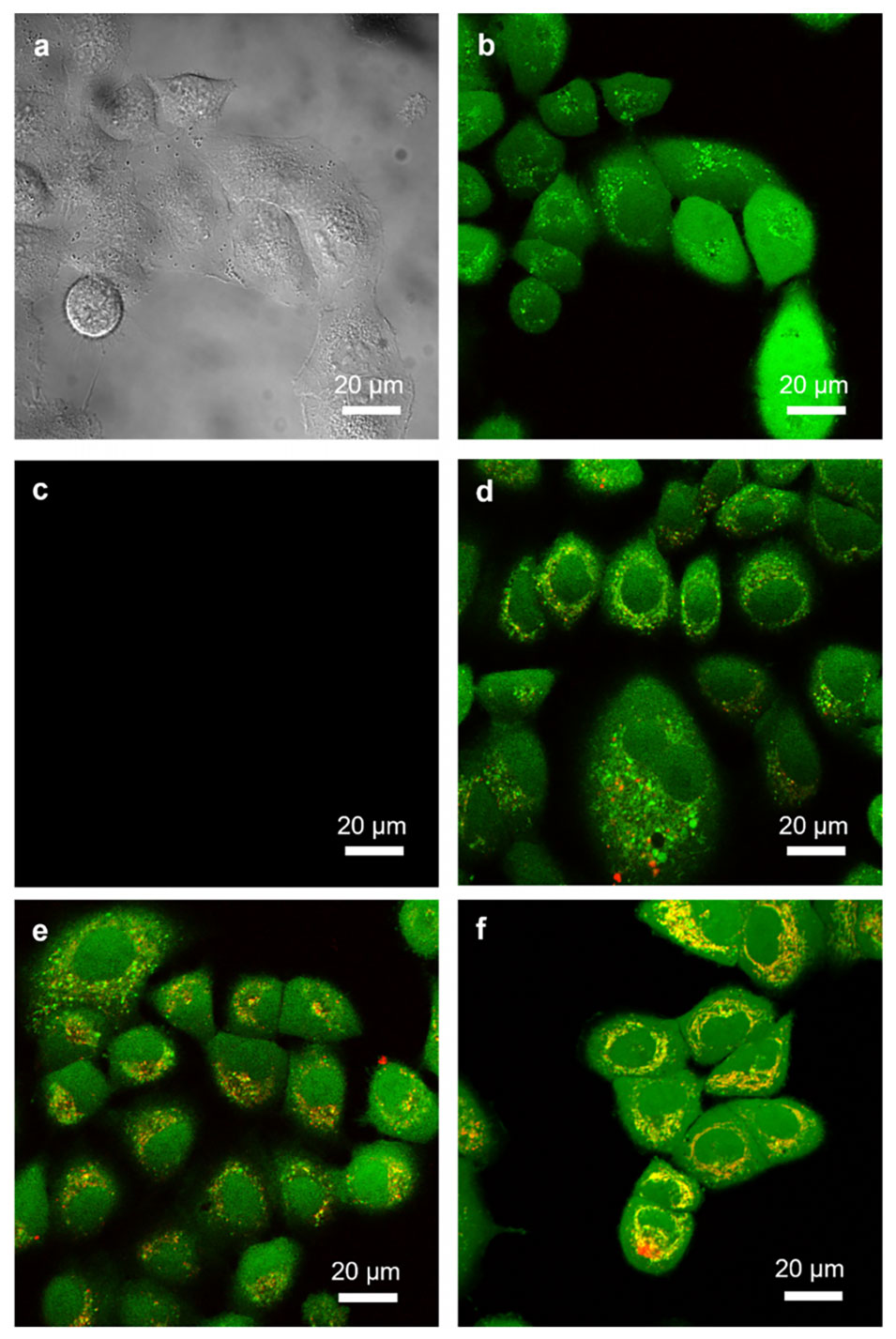
图8:(a)未处理的A549细胞的Nomarski图像;(b)和(c)未处理的A549细胞的共聚焦显微镜图像,分别显示绿色(calcein AM,波长为505–550 nm)和红色(罗丹明,波长为585–700 nm)通道;(d)至(f)A549细胞分别与纳米粒子G2共孵育2小时、4小时以及与纳米粒子PT2共孵育4小时后的共聚焦显微镜图像。这些图展示了纳米粒子被癌细胞摄取的情况。
论文链接:https://doi.org/10.1039/D4SC07746F














