急性肺损伤(ALI)是一种以急性呼吸窘迫、低氧血症和炎症反应为特征的严重肺部疾病。传统治疗方法主要依赖于机械通气和氧疗等支持性措施,但这些方法存在疗效有限和无法精准靶向损伤部位的局限性。药物治疗虽然也是ALI治疗的关键手段之一,但临床上常因药物的副作用而受到限制。
多酚类化合物,如白藜芦醇(Resveratrol,Res),因其显著的抗氧化和抗炎特性而备受关注。然而,白藜芦醇的临床应用面临诸多挑战,主要表现为生物利用度低、在胃肠道和肝脏中的代谢速度快,以及在环境因素(如pH、温度和酶降解)影响下的稳定性差等问题。这些因素共同导致其在体内的有效浓度降低,从而削弱了其治疗效果。因此,开发一种能够提高药物生物利用度、稳定性和靶向性的新型药物递送系统对于ALI的有效治疗具有重要意义。

近期,东华大学生物与医学工程学院史向阳教授团队与同济大学医学院附属第四人民医院放射科主任医师张贵祥和上海交通大学医学院附属新华医院心内科主任医师马静合作,成功构建了一种基于电喷雾技术的核壳微球载药系统,通过协同利用纤连蛋白(FN)的靶向特性和白藜芦醇(Res)的抗氧化与抗炎作用,实现了对急性肺损伤(ALI)的精准联合治疗。相关研究以“Electrosprayed core–shell microspheres co-deliver fibronectin and resveratrol for combined treatment of acute lung injury”为题目,发表在期刊《Journal of Colloid and Interface Science》上。
本文要点:
1、本研究开发了一种电喷雾核壳微球(RPG@FN),用于共递送纤连蛋白(FN)和白藜芦醇(Res)治疗急性肺损伤(ALI)。
2、该微球以聚己内酯-聚乙二醇(PCL-PEG)胶束包裹Res为内核,聚乳酸-羟基乙酸共聚物(PLGA)为外壳,表面修饰FN以靶向巨噬细胞α4β1整合素。
3、体外实验表明,RPG@FN通过FN的RGD肽靶向巨噬细胞,协同发挥Res的活性氧(ROS)清除能力与FN的免疫调节功能,显著抑制促炎因子(TNF-α、IL-6、IL-1β),促进抗炎因子IL-10分泌,并通过调控NF-κB和PI3K/Akt通路增强巨噬细胞M2极化。
4、在小鼠ALI模型中,RPG@FN有效减轻肺水肿和中性粒细胞浸润,修复肺组织损伤,其疗效显著优于单一药物。
5、该微球系统通过延长药物释放、提高生物利用度及靶向递送,展现了良好的生物安全性和协同治疗潜力,为炎症相关疾病的精准治疗提供了新策略。
核壳微球(RPG@FN)的制备过程分为以下三步:
1、Res负载胶束的制备:将白藜芦醇(Res)与两亲性共聚物PCL-PEG共溶于DMSO中,随后滴入水中并超声分散,搅拌24小时后通过透析去除溶剂。超滤纯化后得到粒径约为660.2 nm的Res/PCL-PEG胶束,封装效率达到98.7%。
2、电喷雾构建核壳结构:将PLGA溶解于六氟异丙醇中作为壳层溶液,将Res/PCL-PEG胶束水溶液作为核层溶液。通过同轴电喷雾装置(电压9 kV,核层流速1 mL/h,壳层流速2 mL/h,收集距离15 cm)制备核壳微球。最终得到的PLGA/PCL-PEG/Res(RPG)微球粒径约为928.7 nm,经真空干燥后得到均匀的球形结构(SEM显示平均粒径为1.60 μm)。
3、FN表面修饰:将RPG微球分散于水中,与纤连蛋白(FN)溶液混合并搅拌12小时。通过挤出和离心去除未结合的FN,最终得到表面电位为-25.2 mV的RPG@FN微球。SDS-PAGE及DLS分析证实FN成功修饰,且微球在生理环境中保持稳定(7天内粒径无显著变化)。
靶向递送和抗氧化抗炎作用是如何协同工作的?
1、靶向递送增强局部浓度:FN通过RGD序列特异性结合巨噬细胞表面的α4β1整合素,将微球精准递送至炎症部位(如急性肺损伤的肺泡巨噬细胞),提高Res和FN的局部有效浓度。
2、抗氧化与抗炎的双重调控:
ROS清除:Res直接中和过量活性氧(ROS),减轻氧化应激对肺组织的损伤。
巨噬细胞极化调控:FN促进巨噬细胞向抗炎M2表型转化,抑制促炎因子(TNF-α、IL-6)分泌,同时Res通过抑制NF-κB和PI3K/Akt通路进一步阻断炎症信号传导。
3、协同修复效应:FN的免疫调节与Res的分子干预形成互补,共同恢复线粒体功能、减少中性粒细胞浸润,最终实现肺组织炎症微环境的整体改善。
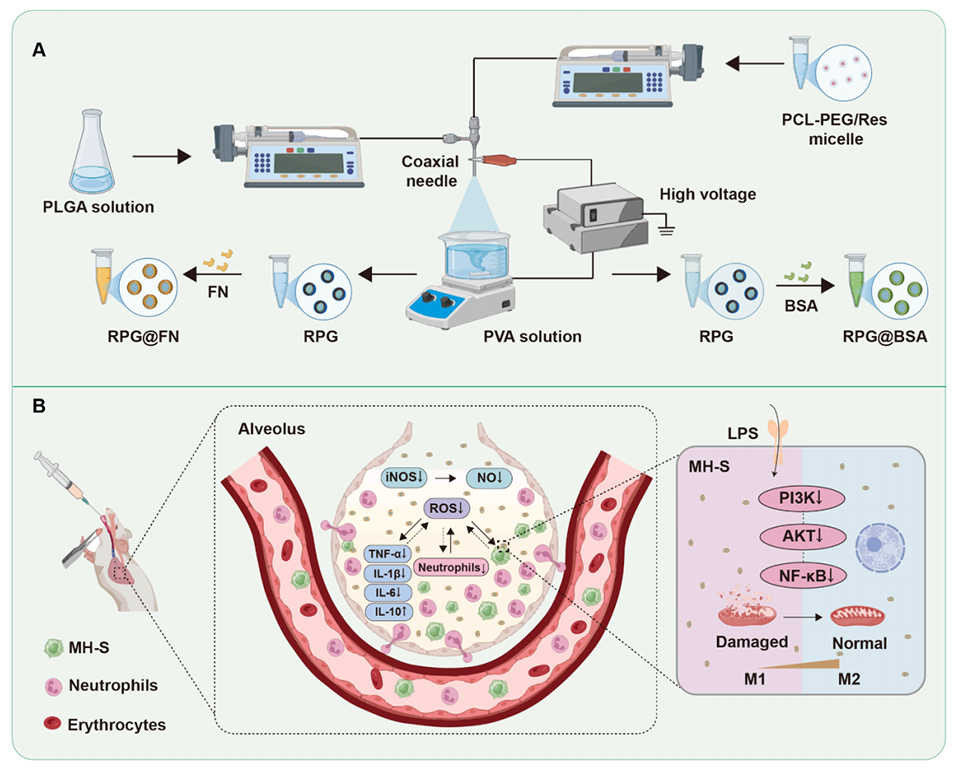
Scheme1.RPG@FN微球设计及其用于急性肺损伤的治疗机制。
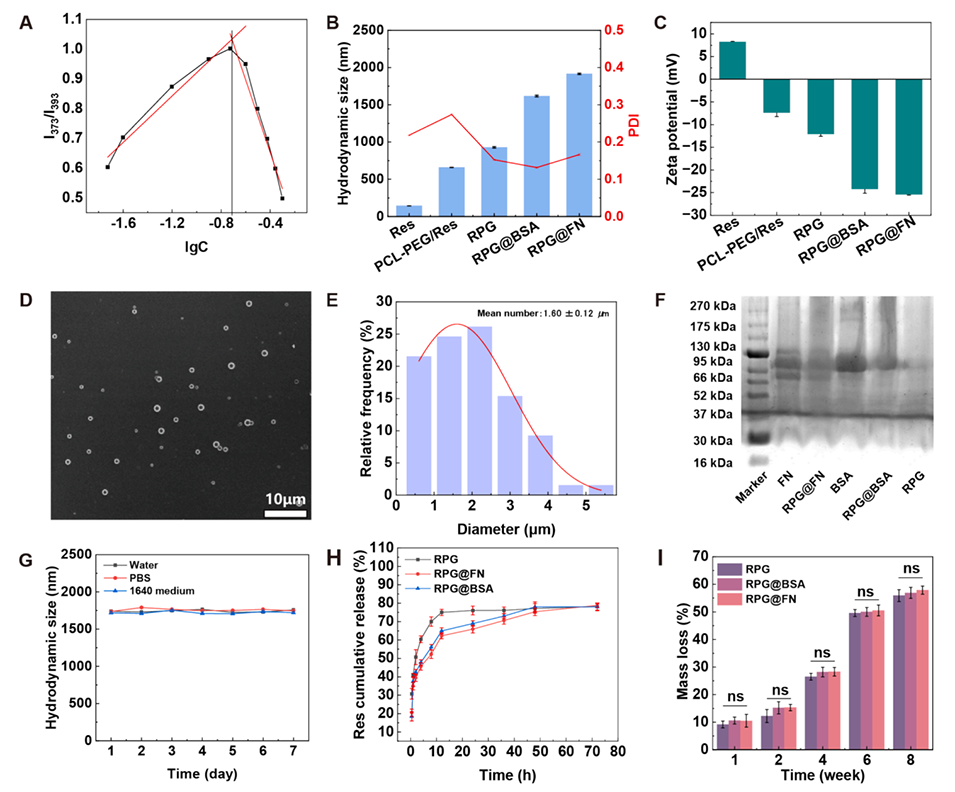
图1.(A)使用芘作为荧光探针测量PCL-PEG胶束的临界胶束浓度(CMC)。(B)游离Res、PCL-PEG/Res、RPG、RGP@BSA以及RPG@FN的流体动力学尺寸和(C)ζ电位。(D)RPG@FN的SEM图像和(E)粒度分布直方图。(F)FN、RPG@FN、BSA、RGP@BSA和RPG的SDS-PAGE分析。(G)RPG@FN分散于水、PBS或含10% FBS的RPMI-1640培养基中不同时间段的流体力学尺寸变化。(H)RPG、RPG@BSA和RPG@FN在PBS中的Res累积释放曲线。(I)RPG、RPG@BSA和RPG@FN在37°C下于PBS中持续8周的体外降解曲线。在(B)、(C)和(G-I)中,n=3,ns表示无显著性。
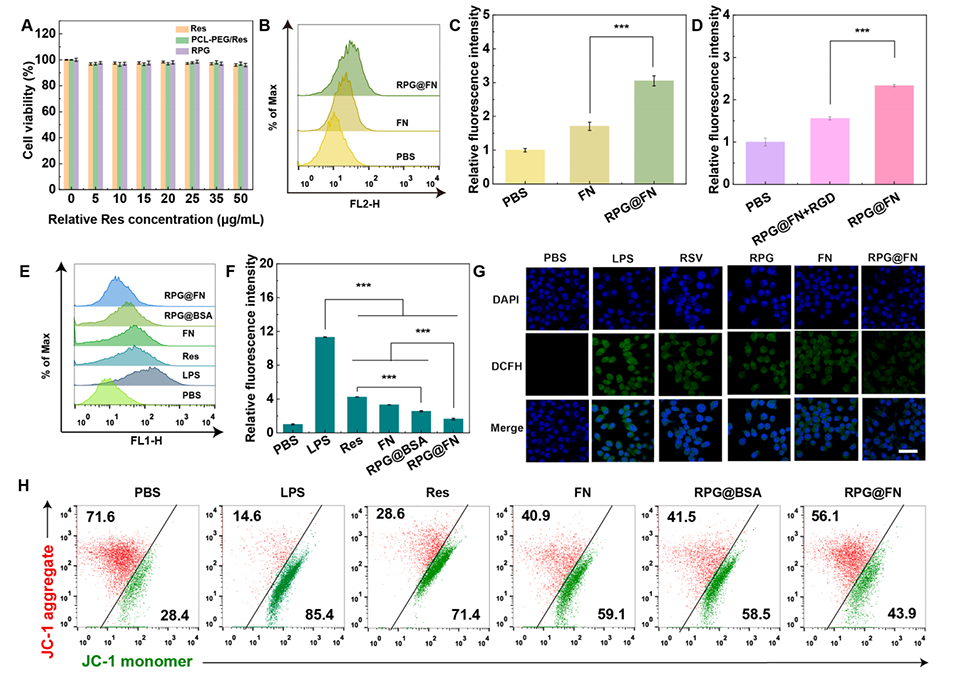
图2.(A)不同浓度Res、PCL-PEG/Res和RPG@FN处理MH-S细胞24小时的活力(n=6)。(B)用PBS、FN或RPG@FN处理MH-S细胞12小时后的荧光强度和(C)定量分析(n=3)。(D)在有无RGD预封闭处理的情况下,用PBS或RPG@FN处理的MH-S细胞荧光强度的定量分析(n=3)。在C-D图中,FN被标记为Cy5.5。(E)不同材料处理12小时后,用DCFH-DA探针染色的MH-S细胞的荧光强度和(F)定量分析(n=3)。(G)LPS激活的MH-S细胞在与Res、FN、RPG@BSA或RPG@FN共孵育6小时、用DCFH-DA染色后的CLSM图像。每张图像的比例尺为40μm。(H)使用JC-1作为荧光探针,对用各种材料处理的MH-S细胞中的MMP进行流式细胞术分析。在图C-D和F中,***表示p<0.001。
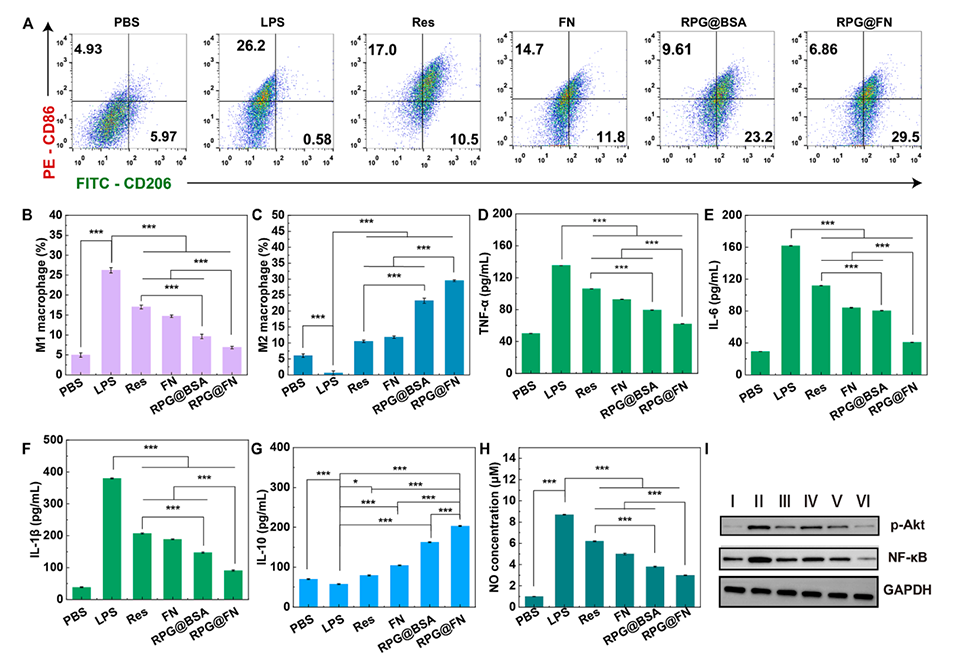
图3.(A)不同处理后MH-S细胞CD86和CD206表达水平的流式细胞术分析。不同处理后(B)CD206阳性和(C)CD86阳性巨噬细胞的百分比。不同处理24小时后MH-S细胞中的(D)TNF-α、(E)IL-6、(F)IL-1β和(G)IL-10水平。(H)对细胞进行不同处理后,细胞培养基中的NO水平。(I)蛋白质印迹(WB)分析不同处理24小时后MH-S细胞中NF-κB与p-Akt的表达水平。在图(I)中,I:PBS;II:LPS;III:Res;IV:FN;V:RPG@BSA以及VI:RPG@FN。在图(B-H)中,n=3,*表示p<0.05,***表示p<0.001。
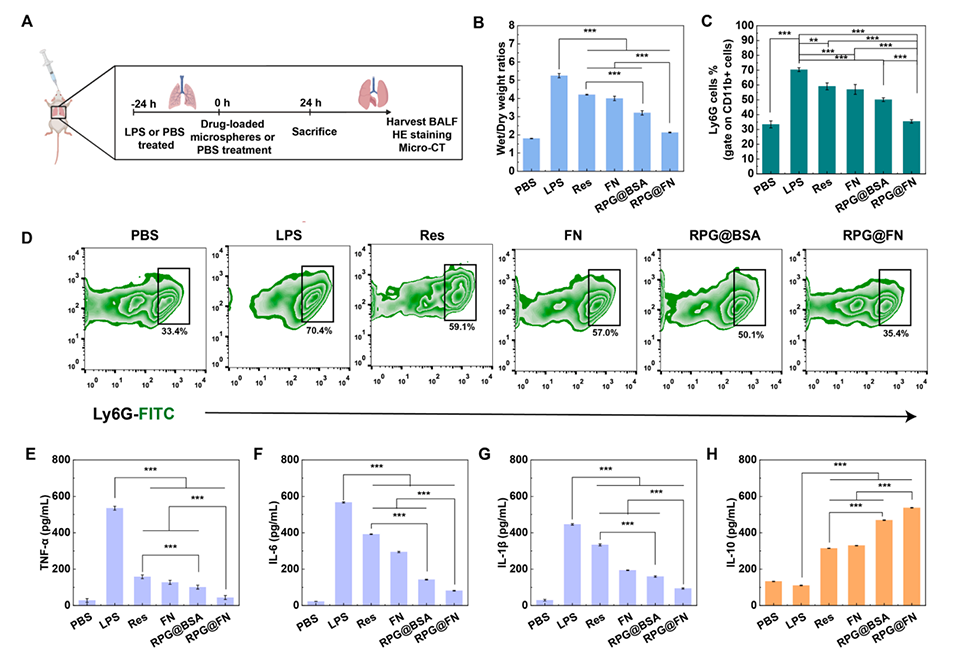
图4.(A)ALI小鼠体内抗炎治疗。(B)不同组ALI小鼠的湿重/干重比。(C)对小鼠进行不同处理后,肺组织中中性粒细胞的百分比。(D)不同处理24小时后ALI小鼠肺组织中性粒细胞的代表性流式细胞术图。(E-H)不同处理后BALF中促炎细胞因子(TNF-α、IL-6和IL-1β)和抗炎细胞因子IL-10的表达水平。在图(B-C)和(E-H)中,n=3,**表示p<0.01,***表示p<0.001。
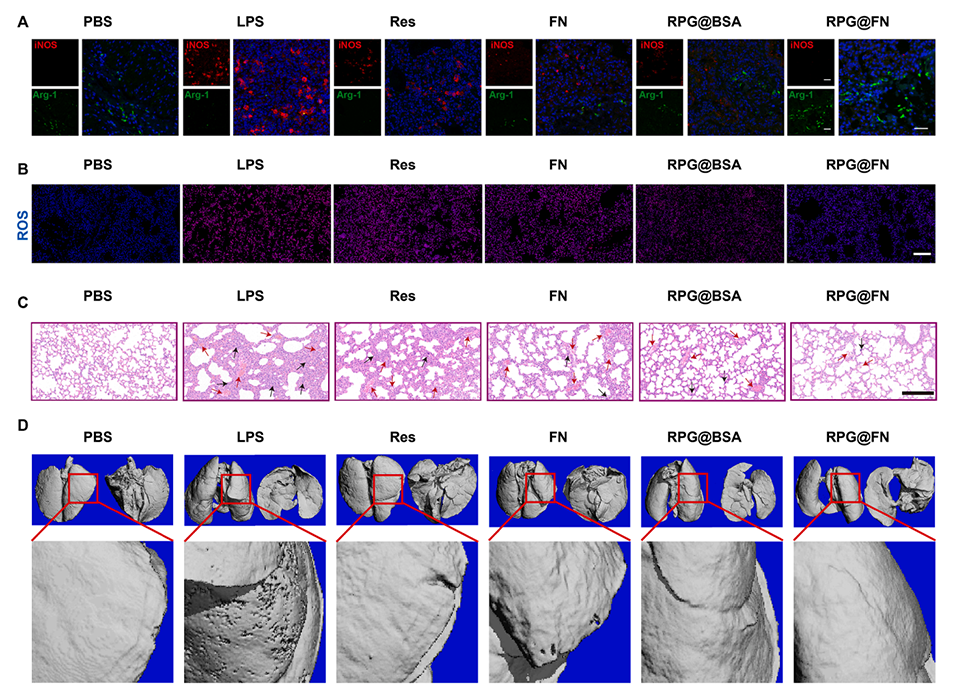
图5.(A)通过免疫荧光染色评估不同治疗后ALI小鼠肺组织中巨噬细胞的极化(蓝色:DAPI;绿色:Arg-1;红色:iNOS)。(B)不同组ALI小鼠肺组织ROS清除作用。图A-B的比例尺=100μm。(C)不同组肺切片的H&E染色和(D)肺组织的显微CT成像。在图(C)中,红色和黑色箭头显示肺泡壁充血和炎症浸润。图C-D的比例尺=200μm。
论文链接:https://doi.org/10.1016/j.jcis.2025.01.249














