
导读:
近期,河北医科大学向柏教授、申海涛教授联合河北医科大学第二医院牛志云副主任医师等人,开发了一种基于微流控技术的脂质纳米颗粒平台,可高效协同递送siRNA和羟氯喹,通过靶向CDK4/6基因沉默和自噬抑制,显著增强乳腺癌的治疗效果。相关研究以“Microfluidic fabrication of lipid nanoparticles for co-delivery of siRNA and hydroxychloroquine: An engineered theranostic platform for enhanced breast cancer treatment”为题目,发表在期刊《Chemical Engineering Journal》上。
本文要点:
1、本文提出了一种基于微流控技术的脂质纳米颗粒(LNP)平台,用于同时递送小干扰RNA(siRNA)和羟氯喹(HCQ),以提升乳腺癌治疗效果。
2、研究通过siRNA介导CDK4/6沉默,实现细胞周期阻滞,同时利用HCQ提高内涵体逃逸效率并抑制自噬,增强治疗效果。
3、体外实验显示,该联合治疗有效阻断自噬、诱导细胞衰老并显著抑制肿瘤细胞增殖;而体内实验则证实,相较单药治疗,该方法显示出更强的抗肿瘤效果且无明显副作用。
4、该工程化LNP平台提供了一种针对核酸与小分子药物同时递送的创新策略,为癌症治疗开辟了新方向。
本研究创新性地设计了一种基于微流控技术的LNP平台,用于协同递送siRNA和HCQ,从多个层面提升抗癌疗效:
siRNA功能:通过沉默与细胞周期相关的CDK4/6基因,抑制细胞周期进展,阻止肿瘤细胞增殖。RNAi的靶向性进一步降低了药物的副作用和抗药性问题。
HCQ功能:一方面抑制自噬,阻止肿瘤细胞利用自噬逃避免疫检测并获取生存优势;另一方面,HCQ通过促进内涵体逃逸,提高siRNA的递送效率,使其更有效地到达细胞质中发挥作用。
协同效果:siRNA与HCQ的结合能够同时抑制细胞周期与自噬两大关键途径,产生更强的抗肿瘤效果,已在体内和体外实验中得到验证。
这种协同递送策略不仅克服了单一药物治疗的局限性,还为癌症治疗开辟了一条新路径,值得深入研究其在其他癌种中的应用潜力。
微流控技术是本研究中LNP制备的核心技术,具有以下重要作用:
1、精准控制组分比例与形貌:微流控技术确保了LNP组分(如DLin-MC3-DMA、Chol、DSPC与DSPE-PEG 2000)按照严格的比例(30:28.5:40:1.5)均匀混合,从而形成平均粒径150~180 nm的稳定球形双层结构。
2、高效核酸与药物包封:微流控技术通过在酸性环境中建立pH梯度,显著提高了siRNA和羟氯喹(HCQ)的包封效率(>80%),并降低了核酸降解的风险。
3、提升药物递送效率:利用微流控制备的LNP具备更高的细胞内化效率,能够减少载体的负表面电荷对细胞膜的排斥,显著提高siRNA的递送效率,同时通过HCQ介导的内涵体逃逸优化核酸释放。
4、稳定性与生物相容性增强:制备的LNP在体外和体内均表现出良好的存储稳定性(可达7天),并在血清条件下有效保护siRNA免受降解,同时具备卓越的血液相容性和低毒性
当前LNP在肿瘤组织的渗透性和分布仍存在不均匀的问题,未来的优化方向包括:
1、深层渗透:研究如何通过调节纳米颗粒表面修饰(如添加多肽或靶向配体)改善其在肿瘤组织中的均匀分布。
2、响应性设计:开发对肿瘤微环境(如pH值或酶活性)敏感的LNP,以实现更精确的药物释放。
3、多功能化:在LNP中整合成像与治疗功能(如加入荧光或磁性材料),以构建诊疗一体化平台,进一步提升临床应用价值。
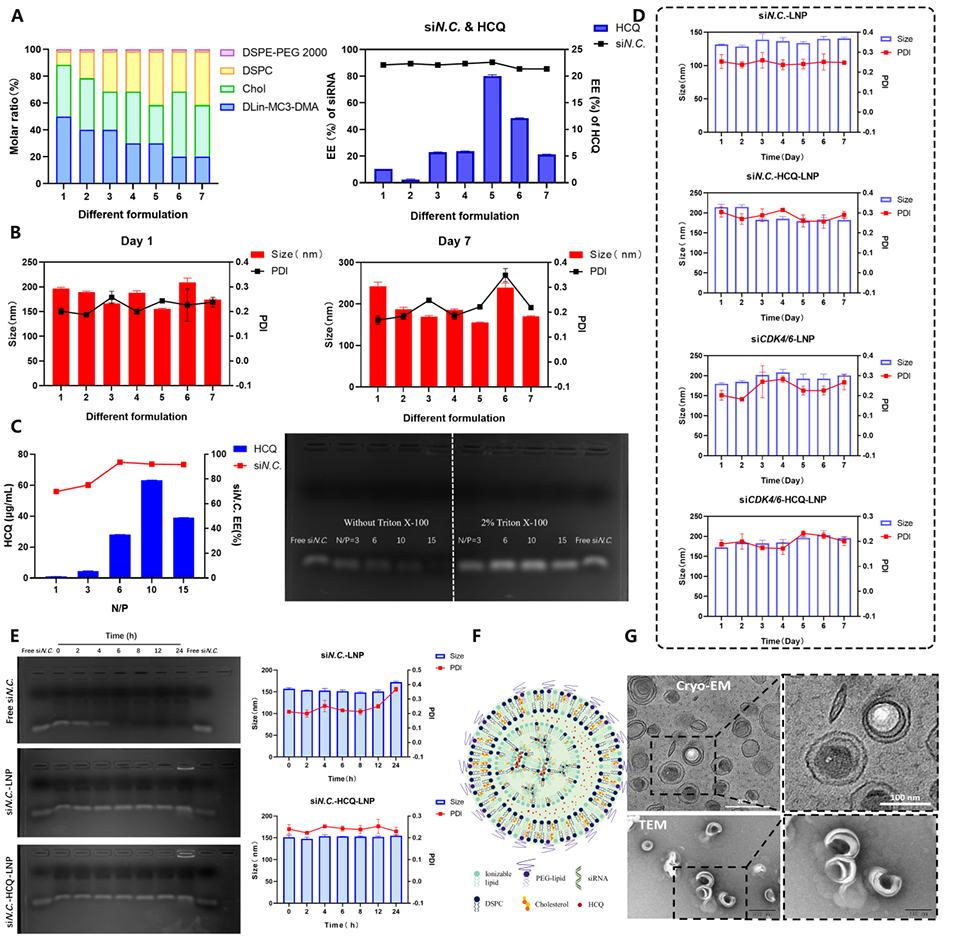
图1.LNPs的表征。
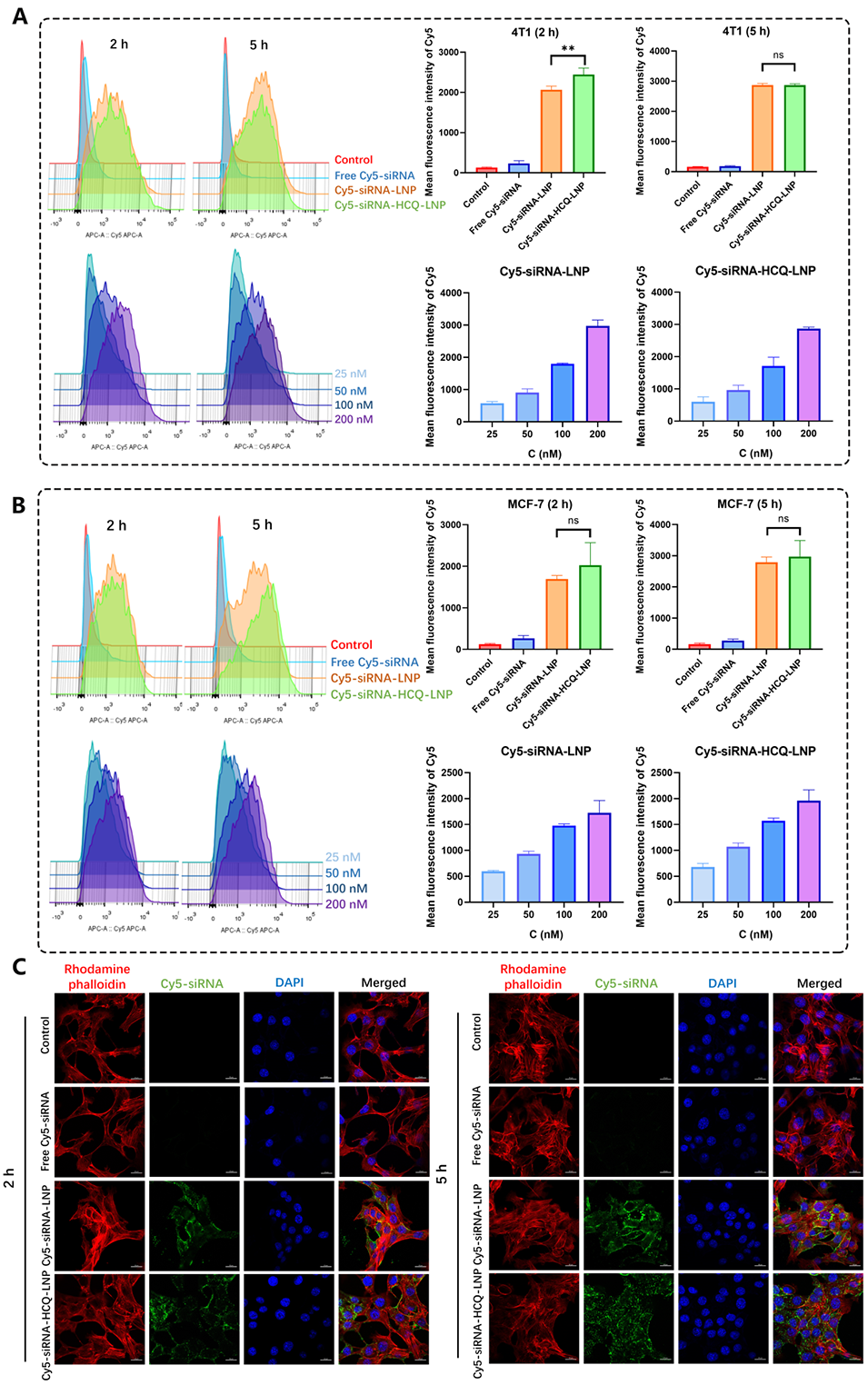
图2.LNPs的细胞摄取。
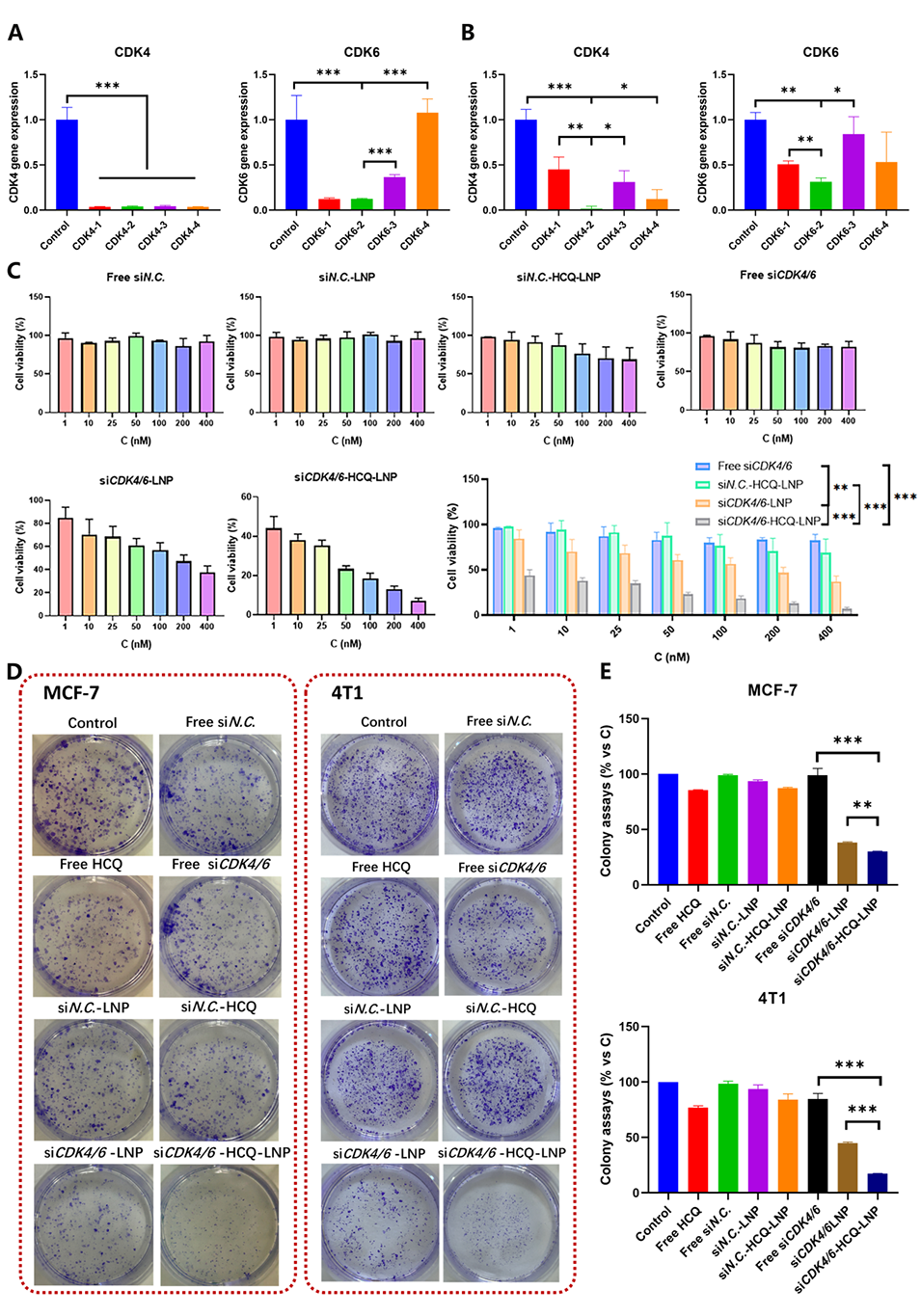
图3.不同处理对细胞增殖的影响。
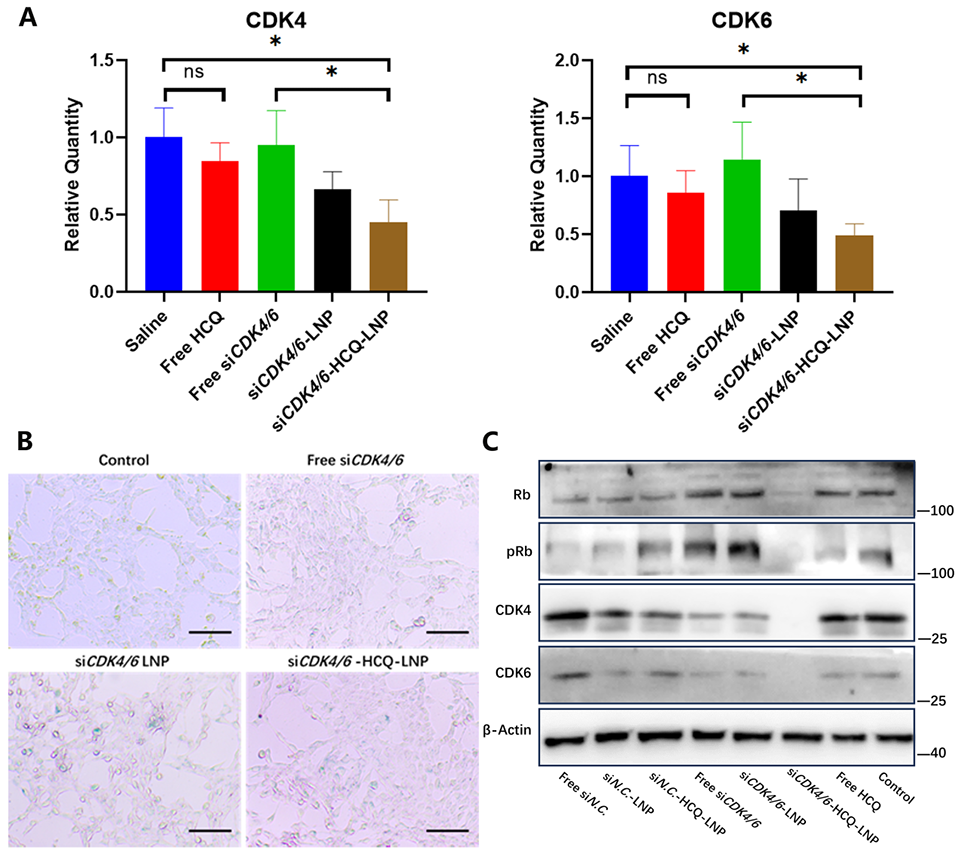
图4.CDK4/6基因沉默效率和细胞衰老评估。
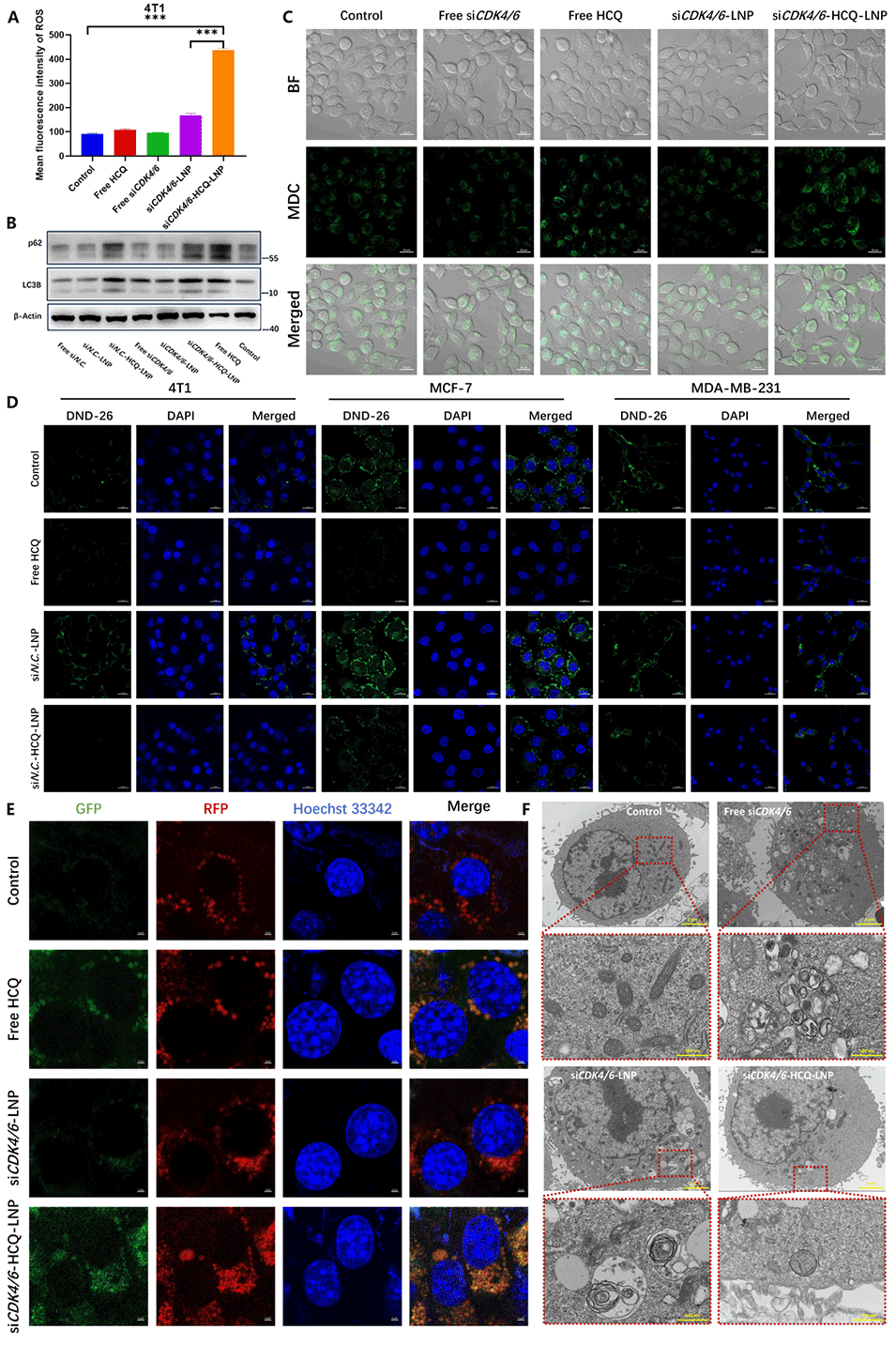
图5.共载LNPs阻断自噬通量。
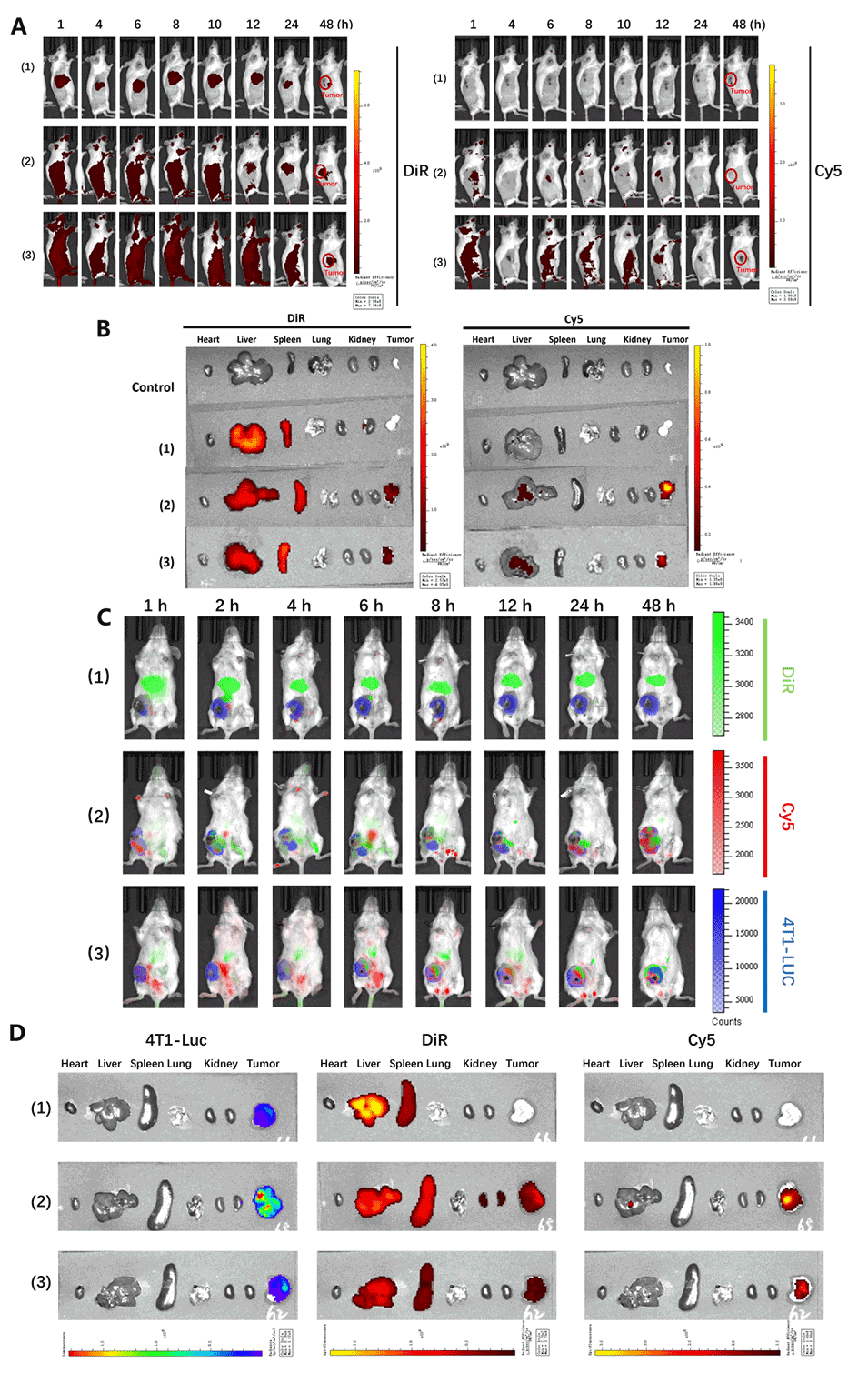
图6.4T1肿瘤模型小鼠体内LNPs的生物分布。
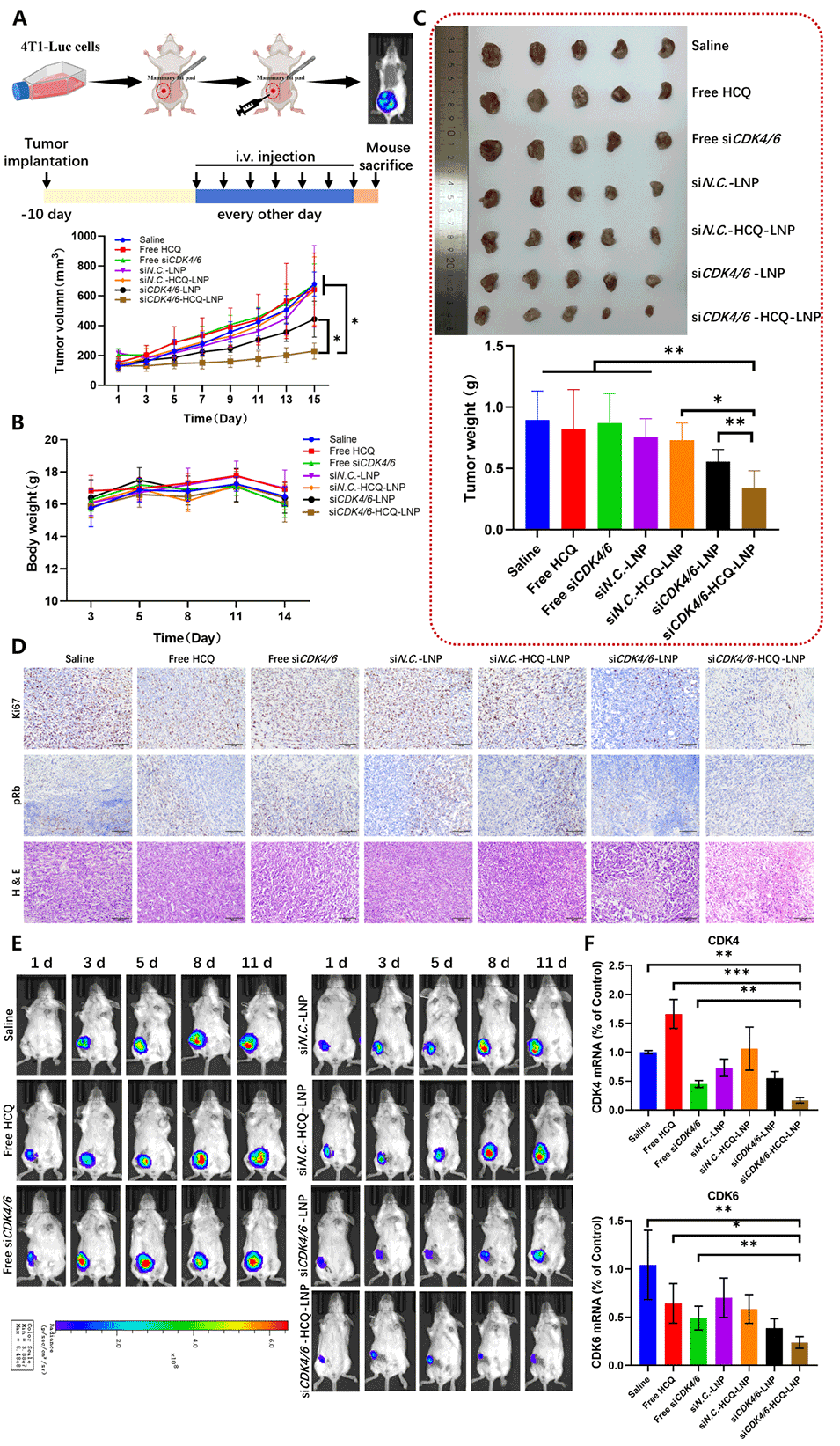
图7.共载LNPs的抗肿瘤功效。
论文链接:https://doi.org/10.1016/j.cej.2025.160172














