干细胞治疗在脊髓损伤治疗中显示出巨大潜力,但其疗效受到移植后细胞存活率低、神经元分化效率低、与宿主组织连接困难等问题的限制。

近期,温州医科大学药学院李校堃院士、王周光研究员等人开发了一种生物工程微球(BEM)平台,通过优化细胞外基质(ECM)的提取和结合多孔聚乳酸-羟基乙酸(PLGA)微球,显著提高了间充质干细胞(MSC)在脊髓损伤治疗中的存活率、保留率以及神经分化能力,从而加速了脊髓损伤后的功能恢复。相关研究以“Bioengineering microspheres regulating mesenchymal stem cell fate accelerate spinal cord injury therapeutics”为题目,发表在期刊《Nano Today》上。
本文要点:
1、本研究开发了一种生物工程微球(BEM)平台,通过调节间充质干细胞(MSC)的命运来加速脊髓损伤(SCI)的治疗。
2、首先获取并优化细胞外基质(ECM),以实现体外有效的神经元分化。
3、利用微流控技术制备了多孔PLGA微球,以支持干细胞的存活和保留。
4、BEM平台结合了ECM和PLGA微球,显著提高了MSC在SCI模型中的存活率、保留率,并促进了其向神经元细胞的分化和组织整合。
5、更重要的是,BEM辅助的MSC治疗减少了瘢痕组织形成,改善了周围组织和轴突的再生,保护了突触结构,并增强了信号传导,从而加速了SCI后的恢复。
微流控技术在制备多孔聚乳酸-羟基乙酸(PLGA)微球中起着关键作用。该技术通过控制流体的流动和混合,能够精确地形成油包水(W/O)乳液,从而生成具有均匀尺寸和良好孔隙结构的微球。这种方法的优势在于:
1、高效性:微流控技术能够快速、连续地生产微球,减少了传统方法中可能出现的批次间差异。
2、可控性:通过调节流速和液体比例,可以精确控制微球的尺寸和孔径,从而优化其细胞载入和迁移特性。
3、均匀性:微流控技术确保了微球的形态和结构的一致性,这对于后续的生物应用至关重要。
因此,微流控技术的应用不仅提高了PLGA微球的制备效率,还增强了其在干细胞治疗中的功能性,特别是在促进间充质干细胞的存活和分化方面。
干细胞治疗脊髓损伤面临的主要挑战包括:
1、细胞存活率低:移植后的干细胞在损伤环境中存活的比例较低,影响治疗效果。
2、神经元分化效率低:干细胞向神经元转化的效率不足,限制了其在修复受损神经组织中的作用。
3、与宿主连接困难:移植的干细胞难以有效地与宿主组织连接,影响其功能整合。
4、不利的微环境:脊髓损伤部位存在炎症和抑制性因子,形成了一个不利于干细胞生存和功能发挥的微环境。
这些挑战限制了干细胞治疗在脊髓损伤中的临床应用效果。
BEM平台在脊髓损伤(SCI)治疗中的作用机制如下:
1、优化的细胞外基质(ECM):
采用基于液氮的去细胞化方法提取的脊髓ECM(oECM)相比传统化学方法(tECM),能够更有效地保留关键成分(如层粘连蛋白),促进MSC向神经元的分化。
oECM在体外实验中显示出显著提高MSC的神经元标志物(如MAP2和DCX)的表达,表明其在促进神经元分化方面的有效性。
2、多孔微球的应用:
通过微流控技术制备的多孔聚乳酸-羟基乙酸(PLGA)微球,提供了良好的细胞载入和迁移特性,支持MSC的存活和保留。
这些微球的多孔结构为MSC提供了一个适宜的微环境,促进了细胞的生长和分化。
3、生物活性微球(BEM)平台:
将优化的ECM与PLGA微球结合形成的生物活性微球(BEM),能够显著提高MSC的存活率和保留率。
BEM不仅支持MSC的生存,还促进其向成熟神经元的转化,并有效整合到宿主组织中。
4、减少瘢痕形成和促进组织再生:
BEM辅助的MSC治疗能够减少瘢痕形成,保护神经元和轴突结构,增强信号传导,从而加速脊髓损伤后的功能恢复。

图1.生物工程ECM在2D培养中促进MSCs分化。
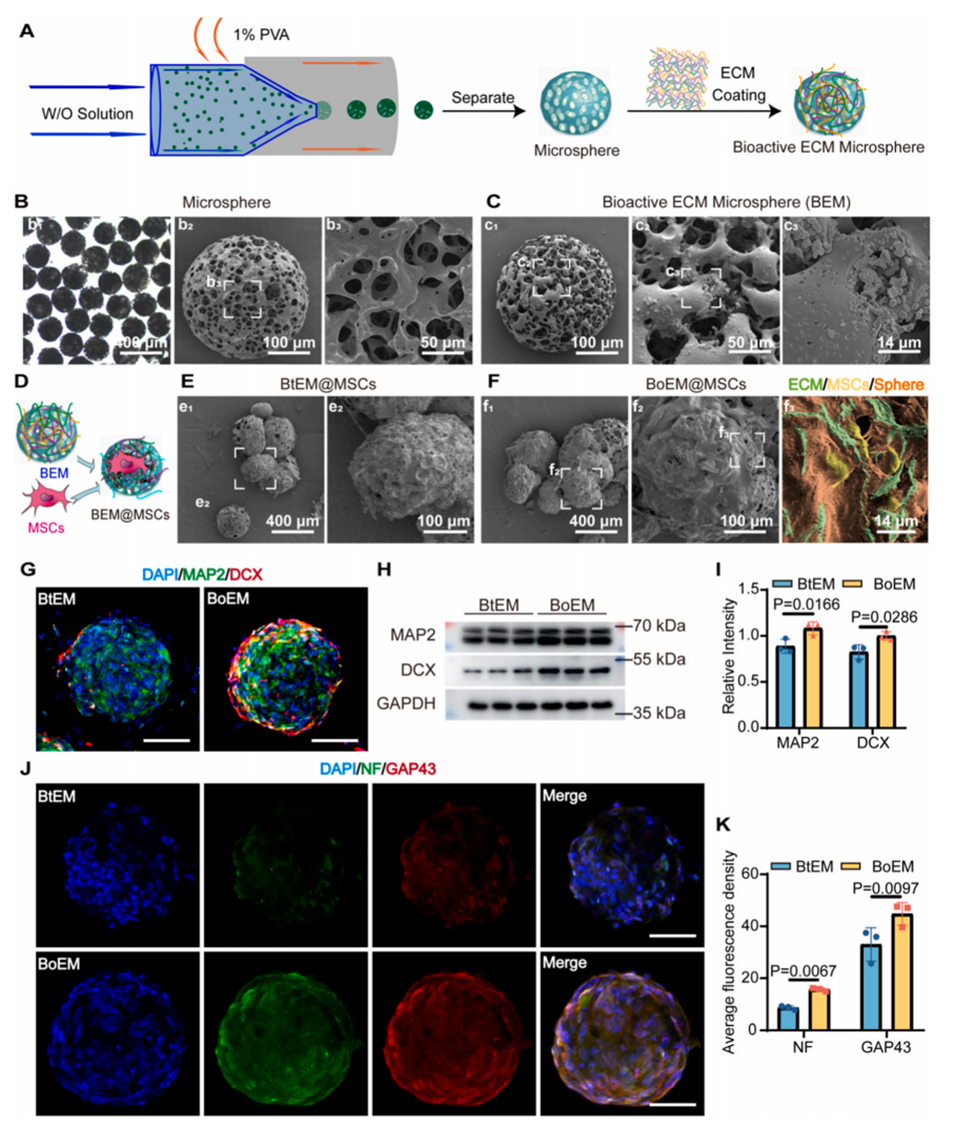
图2.成功制备生物工程微球并促进MSC在3D培养中的分化。
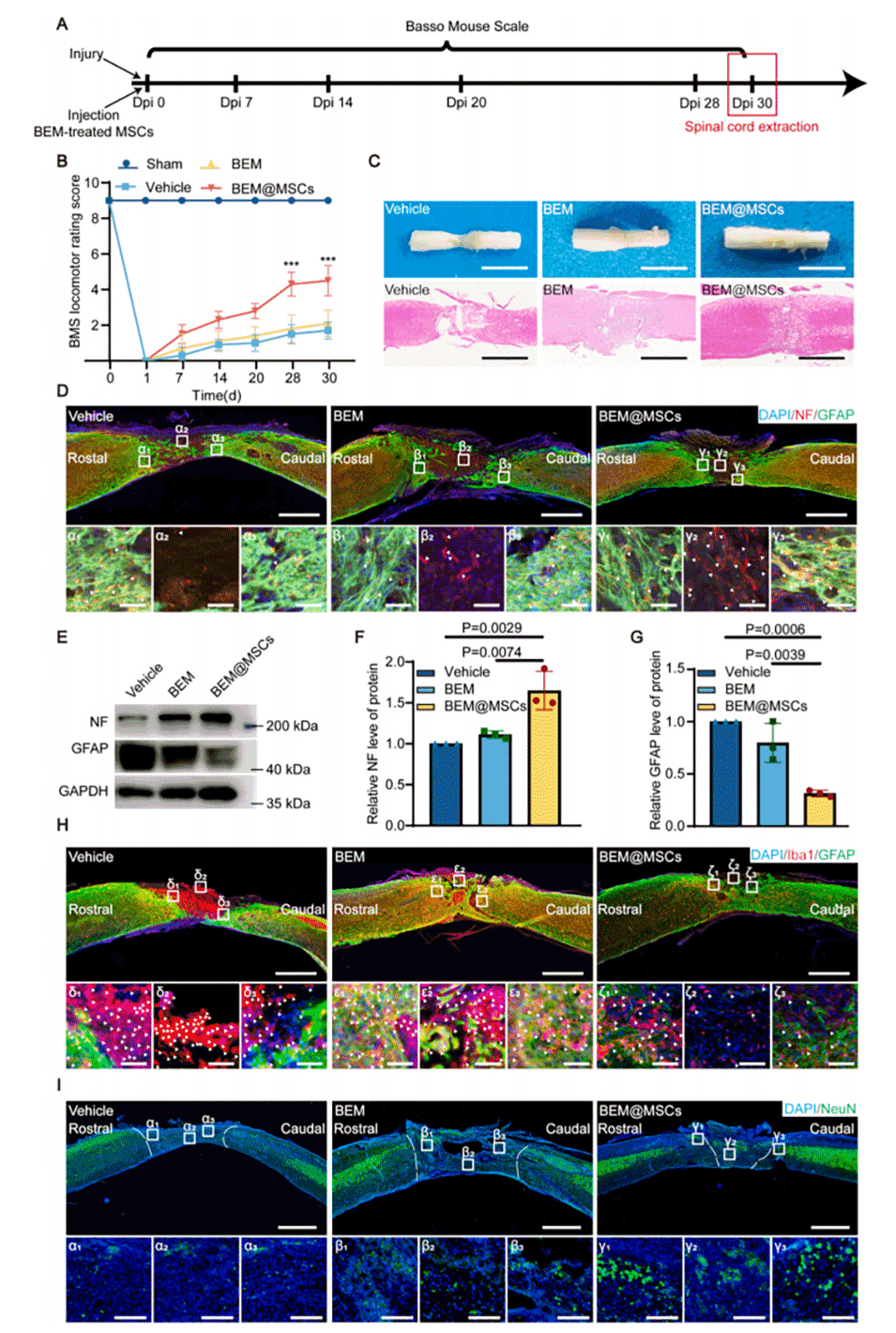
图3.通过BEM支持的MSCs治疗成功促进SCI小鼠的恢复。
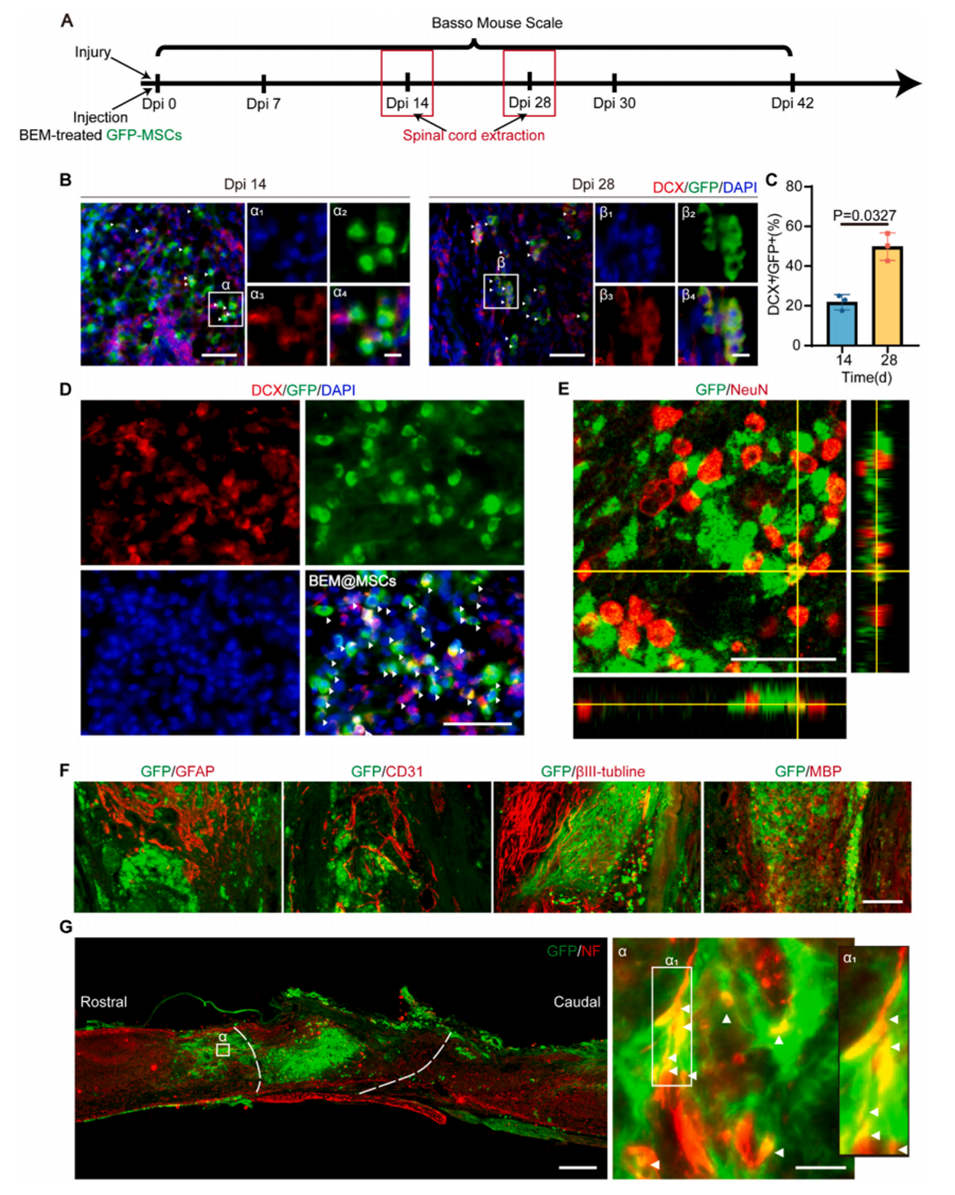
图4.植入的BEM@MSCs在损伤脊髓中转化为成熟神经元。
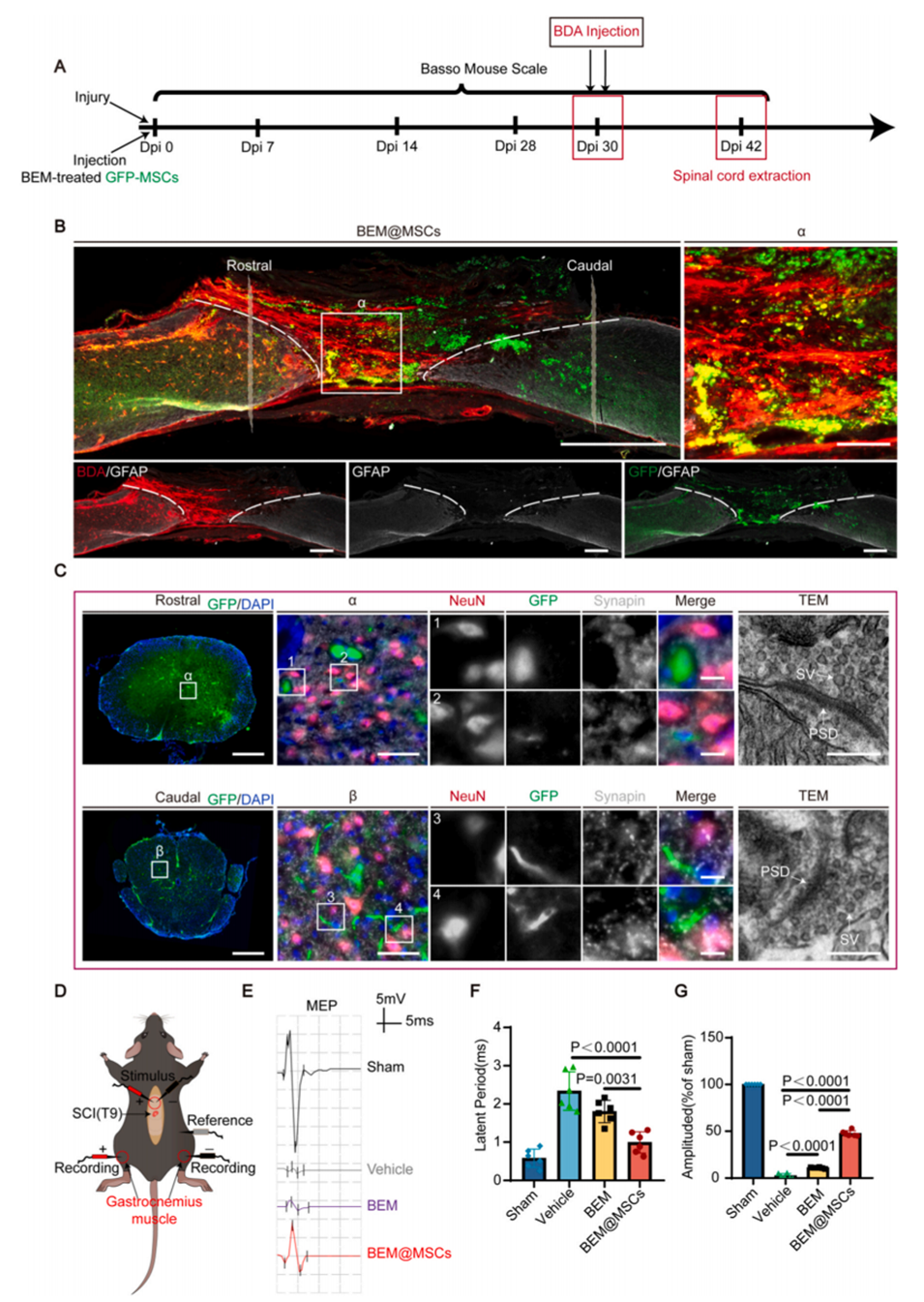
图5.BEM处理的MSCs和宿主神经元之间的神经连接。
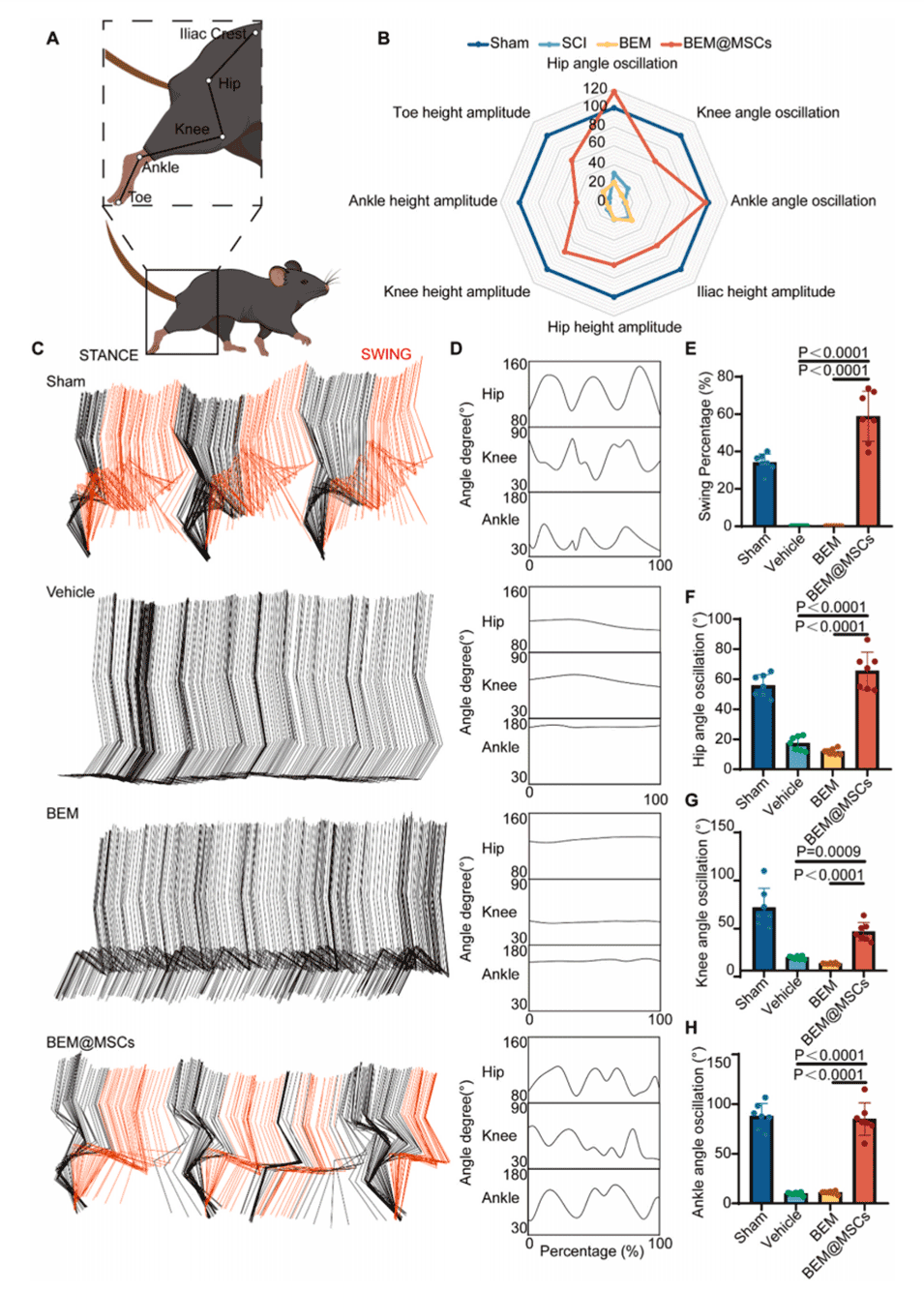
图6.SCI小鼠后肢运动恢复的综合评价。
论文链接:https://doi.org/10.1016/j.nantod.2024.102574














